
3.氧化还原反应
(1)了解氧化还原反应的概念,并能正确判断氧化剂、还原剂、氧化产物、还原产物。
(2)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。
2.化学用语及常用计量
(1)熟记并正确书写常见元素的名称、符号、离子符号。
(2)熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
(3)了解原子结构示意图、分子式、结构式和结构简式的表示方法。
(4)了解相对原子质量、相对分子质量的定义,并能进行有关计算。
(5)理解质量守恒定律的含义。
(6)了解物质的量的单位--摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
(7)根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
考纲要求
1.物质的组成、性质和分类
(1)了解分子、原子、离子等概念的含义。了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
27.(10分)请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测
NCl3水解的主要产物是 (填化学式)。
26.(10分)下图A、B、C、D、E、F、G均为有机化合物
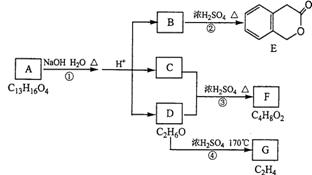
根据上图回答问题:
(1)D的化学名称是__________,
(2)反应③的化学方程式是_________________________________。(用结构简式表示)
(3)B的分子式是_______________。
A的结构简式是________________。反应①的反应类型是_______ _________。
(4)符合下列3个条件的B的同分异构体的数目有______个。
①含有邻二取代苯环结构 ②与B有相同官能团 ③不与FeCl3溶液发生显色反应。
写出其中任意一种同分异构体的结构简式________________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要工业用途
______________________________________________。
25.近期大面积持续“油荒”、“电荒”,严重影响了工业生产,人民的生活,能源成了我们亟待解决的问题.目前,我国的能源结构主要是煤,还有石油、天然气、核能等,这些能源都是一次不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务.科学家预测“氢能”将是未来21世纪最理想的新能源.
(1)目前世界上的氢绝大部分是从石油、煤炭和天然气中制取.请写出工业上由天然气制氢气的化学反应方程式.
(2)利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为:
2H2O  2H2+O2,其循环过程分三步进行:
2H2+O2,其循环过程分三步进行:
(a)SO2+I2+H2O→A+B (b)A→?+? (c)B→?+?+?
①完成以上三步反应,并确定哪步反应最难进行.
②请对硫-碘热循环法制取氢的优劣和前景作一分析.
24.(12分)氯化铜晶体(CuCl2·2H2O)含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下列操作步骤进行提纯:
①先加入氧化剂X,再加入物质Y,过滤得沉淀Z;
②将滤液蒸发结晶得纯CuCl2·2H2O晶体。
已知:三种离子从溶液中完全呈氢氧化物沉淀所需pH值:Fe3+:3.7,Cu2+:6.4,Fe2+:6.4试回答下列问题:
(1)加入氧化剂X的原因是____ __。
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是( )
A.H2O2 B.KMnO4 C.NaClO D.K2CrO7
(3)物质Y是__ ____,沉淀Z是__ ____.
(4)为分离出沉淀Z,采取的实验操作所用仪器有__ ____。
(5)操作②所用的仪器有____ __。
23.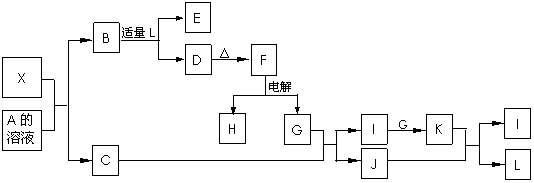 (12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
(12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________ __________;
写出K与J反应的化学方程式:____________________________ _____。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。 +2N2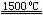 4X+SiC+3C。
4X+SiC+3C。
22.(06全国Ⅱ)(10分)以下一些氧化物和单质之间可以发生如下图所示的反应:

其中,氧化物(I)是红棕色固体,氧化物(II)、(III)、(IV)在反应条件下都是气体。
(1)氧化物(I)的化学式(分子式)是 。
氧化物(II)的化学式(分子式)是 。
(2)反应①的化学方程式是 。
反应②的化学方程式是
反应③的化学方程式是
21.(06重庆卷)(13分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________________________。
(2)ZW2的电子式是____________,它在常温下呈液态,形成晶体时,属于______晶体。
(3)工业生产单质Y的原理是_____________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是__________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br-的物质的量之比是___________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com