
20. (9分)实验室用50ml浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平):KClO3 + HCl -- KCl + Cl2 ↑+ H2O
(1)配平上述反应化学方程式:
____ KClO3 +___ HCl ==__ KCl +__ Cl2 ↑+__ H2O
(2)浓盐酸在反应中显示出来的性质是 (填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1molCl2,则转移电子的物质的量为 mol.
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物多7.1g时,则浓盐酸的物质的量浓度为 。
19.(10分)为测定大理石中碳酸钙的纯度(设含杂质SiO2),某兴趣小组设计了如下方案:
①称取碳酸钙样品mg ②将样品充分高温煅烧,冷却后称量,剩余固体质量为m1g。
(1)该方案中应在 (仪器名称)中高温煅烧;
判断碳酸钙样品完全分解的方法是 ;
“冷却”应如何操作____ ;
理由是_____ _____ .
(2)有同学认为方案中高温煅烧的过程中会发生CaCO3 + SiO2 CaSiO3
+ CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗? ,(填“正确”或“错误”)
CaSiO3
+ CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗? ,(填“正确”或“错误”)
请说明自己的理由: 。
18.(10分)下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体或溶液,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
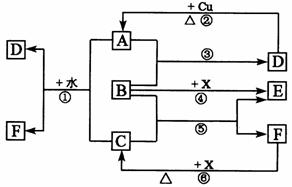
试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_________。(用化学式表示)
(2)B的电子式为:_________。
(3)写出反应⑤的化学方程式:________________。
(4)写出反应①、②的离子方程式:
①________________ _ ________
②_________________ ________
17.(16分)现有A、B、C、D四种短周期元素,A元素的原子半径是短周期元素中除稀有气体外半径最大的,B元素的原子最外层比次外层多3个电子,C元素是人体所含元素中质量分数最大的,D元素的一种同位素的质量数与质子数相等。请据此填空:
(1)A的原子结构示意图是 ;B2分子的电子式是 。
(2)C元素常见单质的化学式为 、 。
(3)C和D可形成电子数相同的两种粒子,该两种粒子反应后生成一种中性分子,反应的离子方程式是 。
(4)D2C2分子为 分子(填极性或非极性)
(5)A与B形成的一种化合物中,A元素的质量分数为35.4%,该化合物的摩尔质量不超过70g/mol,则该化合物的化学式是 ,其中可能有的化学键为 。
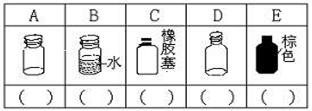
16. (1)(5分)实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D、E是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内。
①氢氧化钠溶液 ②浓硫酸 ③碳酸钠溶液 ④白磷 ⑤大理石 ⑥酒精 ⑦AgNO3溶液
(2)、(5分) 某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加得罗常数为NA,则:
①该气体的物质的量为: mol
②该气体在标准状况下的体积为: L
③该气体在标准状况下的密度为: g/L
④该气体所含的原子总数为 个
⑤该气体的一个分子的质量约为 g。
15. VL浓度为0.5mol/L的盐酸,欲使其浓度增大1倍,可采取的措施是( )
A.通入标准状况下的HCI气体11.2L
B.加入10mol/L的盐酸0.1VL,稀释至1.5VL
C.将溶液加热浓缩到0.5VL
D.加入VL1.5mol/L的盐酸混合均匀
第Ⅱ卷 非选择题(共55分)
14.常温下,某饱和石灰水的PH=12,密度为dg/cm3,则该温度下Ca(OH)2的溶解度为( )
 A.
B..
C. D.
A.
B..
C. D.
13.将标准状况下体积为224 mL的Cl2通入到25.00 mL 0.1 mol · L – 1 Na2S2O3溶液中恰好完全反应,此时Cl2全部转化为Cl –,则S2O32-转化为( )
A.SO42- B.SO32- C.S D.S2 -
12.运用元素周期律分析下面的推断,①铍(Be)的氧化物的水化物可能具有两性,②铊(Tl)既能与盐酸作用产生氢气,又有跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性很强,③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀硝酸,④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,⑤硫酸锶(SrSO4)是难溶于水的白色固体,⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体。其中错误的是:( )
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
11. X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的三倍。下列有关叙述正确的是( )
A.X、Y、Z三种元素可形成化合物X3YZ4
B.X、Y两元素形成的化合物只可能为离子晶体
C.Y、Z 两元素形成的化合物熔点较低
D. Y的氢化物的稳定性大于Z的氢化物的稳定性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com