
17.以下自发反应可用能量判据来解释的是
( )
A.2H2(g)+O2(g)=2H2O(l);
△H=-571.6 kJ/mol
B.2N2O5(g)===4NO2(g)+O2(g); △H=+56.7kJ/mol
C.(NH4
)2CO3(s)=NH4HCO3(s)+NH3(g); △H=+74.9
kJ/mol
D.硝酸铵自发地溶于水
16.下列能用勒沙特列原理解释的是
( )
①棕红色NO2加压后颜色先变深后变浅 ②.FeCl3溶液加热后颜色加深 ③.Fe(SCN)3溶液中加入固体KSCN后颜色变深 ④氯水宜保存在低温、避光条件下 ⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 ⑥. SO2催化氧化成SO3的反应,往往加入过量的空气⑦向AgCl悬浊液中加入KI溶液有黄色沉淀生成
A.①②⑤⑥
B.②③④⑦. C.①③⑤⑦ D.全部
15.在体积可变的密闭容器中,反应mA(气) + nB(固)
 pC(气)达到平衡后,压缩容器的体积, 发现A的转化率随之降低。下列说法中,正确的是
( )
pC(气)达到平衡后,压缩容器的体积, 发现A的转化率随之降低。下列说法中,正确的是
( )
A.(m + n)必定小于p
B.(m + n)必定大于p 
C.m 必定小于p
D.m 必定大于p
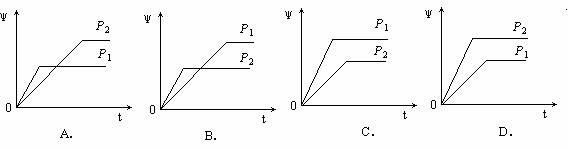
14.在一定温度不同压强(P1<P2)下,可逆反应2X(g)  2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是 ( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是 ( )






13.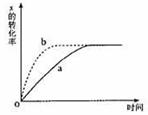 右图曲线a表示放热反应 X(g)+Y(g)
右图曲线a表示放热反应 X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
( )
A.升高温度
B.加催化剂 C.加大X的投入量 D.增大体积
12.在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g)
N2O4(g)
达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 ( )
A.不变
B.增大
C.减小
D.无法判断
11.在一定条件下,将1 mol的CO和水蒸气放入密闭容器中发生反应:CO+H2O CO2+H2,达平衡时测得CO2为0.6 mol,再通入4 mol水蒸气,达到新平衡后,CO2的物质的量为 ( )
CO2+H2,达平衡时测得CO2为0.6 mol,再通入4 mol水蒸气,达到新平衡后,CO2的物质的量为 ( )
A.等于0.6 mol
B.等于1
mol C.大于0.6 mol,小于1 mol D.大于1 mol
10.某温度时有以下反应:S2Cl2(液、无色)+Cl2(气)  2SCl2(液、红色)(正反应放热),在密闭容器中达到平衡,下列说法不正确的是
( )
2SCl2(液、红色)(正反应放热),在密闭容器中达到平衡,下列说法不正确的是
( )
A.升高温度,压强不变,液体颜色变浅
B.温度不变,缩小容器体积,液体颜色加深
C.温度不变,增大容器体积,S2Cl2的转化率降低 D.温度降低,体积不变,Cl2的转化率降低
9.将4 mol A气体和2 mol B气体在2
L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g),若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应速率为0.3 mol ·L-1·s-1②用物质B表示的反应速率为0.6 mol ·L-1·s-1
③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol ·L-1其中正确的是 ( )
A.①③
B.①④
C.②③
D.③④
8. 常温下,分别将四块形状相同、质量均为7g的铁块同时投入下列四种溶液中,产生气体速率最快的是
( )

A.150mL 2mol/L 盐酸 B.
500mL 2mol/L硫酸
C.50mL 3mol/L盐酸 D.
50mL 18.4mol/L硫酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com