
28.(6分)标准状况下,700L NH3溶于1L水中,所得溶液密度为0.90g/mL。求氨水的质量分数与物质的量浓度。
27.(8分)实验室里常见到右图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验。当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点。
 (1)用此仪器不能反复进行的实验是 (填序号)
(1)用此仪器不能反复进行的实验是 (填序号)
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷一定温度下互相转变
D.无水CuSO4和胆矾的互变实验
(2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验,该实验的操作过程和实验现象是 。
(3)如果玻璃管内装有大量红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是 ;如果玻璃管内封有少量无色溶液,加热溶液时,溶液变红,冷却后恢复无色。此溶液可能是 。
26.(12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。 (1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其实验操作方法为: 。 如何确定E中空气已被赶尽: 。
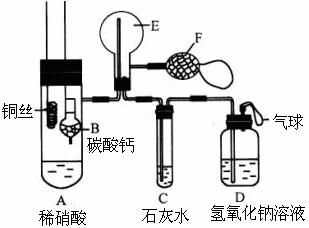
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其
反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2? 。
一段时间后,C中白色沉淀溶解,其原因是 。
(4)装置D的作用是 。
25.(14分)在密闭容器中的可逆反应CO(g)+NO2(g) 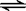 CO2(g)+NO(g)(正反应放热)达到平衡后:
CO2(g)+NO(g)(正反应放热)达到平衡后:
(1)扩大容器体积,平衡 ,c(NO2)将 ,反应混合物的颜色 。
(2)容器体积不变,升高温度平衡 ,体系的压强 。
(3)加入催化剂,NO的物质的量 ,原因是 。
24.
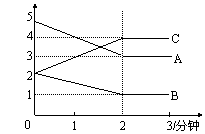 (8分)某可逆反应进行过程中,在不同反应时间
(8分)某可逆反应进行过程中,在不同反应时间
各物质的量的变化情况如图2-4所示。则该反应的化
学方程为 ;反应开始至2
分钟,能用C表示反应速率吗?
(填“能”或“不能”),原因 。
23.(8分)可逆反应aA(g)+bB(g) 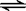 cC(g)+dD(g),取a mol A和b mol B置于V L容器内1 min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 ,C的浓度为
,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 ,A的转化率为 (用字母表示)。
cC(g)+dD(g),取a mol A和b mol B置于V L容器内1 min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 ,C的浓度为
,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 ,A的转化率为 (用字母表示)。
22.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总体积不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
金雁中学2008级10月考化学试题
选择题答题表
21.V1L H2和V2L N2在一定条件下反应,反应达平衡后混和气体为V3L(都在同温同压下测得),则生成NH3的体积是
A.V1+V2-V3 B.V1+V2+V3 C.2(V1+V2)-V3 D.无法计算
20.对可逆反应:A(g) + B(s)  C(s) + D(g);(正反应吸热)。下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:
C(s) + D(g);(正反应吸热)。下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:
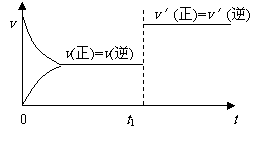


①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是
A.②③ B.①② C.③④ D.④⑤
19.下图表示可逆反应mA(g)+nB(g) pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
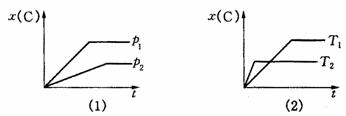
A.吸热反应,m+n<p B.吸热反应,m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com