
2. 硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在_______的郊区(填选项的标号)。
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2 (g) + 1/2O2
(g)  SO3 (g)
;△H= -98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t 98%硫酸只需外界提供(或可向外界输出)多少kJ能量?
SO3 (g)
;△H= -98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t 98%硫酸只需外界提供(或可向外界输出)多少kJ能量?
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为_________________________________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO和SO3在沸腾炉中化合而成),其中CuSO4的质量分数随沸腾炉温度不同而变化(见下表)。
|
沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
|
矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因。
[例1]在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因都正确的是
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需净化和干燥,因为炉气中SO2会与杂质反应
C.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,而影响SO3的吸收
D.热交换器中冷、热气体流动方向相反的目的是为了使热交换充分
[例2]有A、B、C、D四个中等城市,它们水源、能源充足、交通便利。它们的相对地理位置如图,各城市各有特点:A城是风光秀丽、人口稠密、土地供应紧张的旅游城市,环保要求高,近郊有丰富的FeS2资源。B城是一个新兴工业城,已建有大型磷肥厂,土地供应充足。C城近郊有丰富的磷灰石资源,工业发达,但使用H2SO4的工业不多,土地供应充足。D城是一个古老城市,它的周围是重要的农业区,是大量肥料的集散地。现拟建年产10万吨的黄铁矿制硫酸的工厂,工厂厂址应选在 A.A城近郊 B.B城近郊 C.C城近郊 D.D城近郊 三、当堂反馈
1.(2003年上海,15)在NH3、HNO3、H2SO4的工业生产中,具有的共同点是
A.使用吸收塔设备 B.使用尾气吸收装置 C.使用H2作原料 D. 使用催化剂
2、关于硫酸工业综合经济效益的讨论
(1)环境保护与原料的综合利用。化工生产必须保护环境,严格治理“三废”,并尽可能把“三废”变为有用的副产品,实现原料的综合利用。硫酸厂的“三废”经处理后,不仅消除了污染,而且也使SO2和黄铁矿矿渣得到合理利用。
①尾气吸收:硫酸工业的尾气中含SO2等气体,直接排放会污染大气,工业上常用氨水吸收有毒气体:2NH3•H2O + SO2= (NH4)2SO3+H2O,反应后再向其中加入稀硫酸:(NH4)2SO3+H2SO4= (NH4)2SO4+SO2↑+H2O,这样制得纯度较高的SO2,返回车间制硫酸或作他用,另一产物(NH4)2SO4可用作氮肥。
②污水处理:硫酸生成过程中生成的污水中含有H2SO4等杂质,可用石灰乳中和处理:Ca (OH)2 +H2SO4= CaSO4 + H2O,从而可制得石膏。
③废渣的利用:沸腾炉中出来的炉渣可作为制水泥或砖的原料或炼铁。
(2)能量的充分利用。许多化学反应是放热反应,化工生产中应充分利用反应热,以降低生产成本。硫酸生产中的反应热得到充分利用后,不仅不需要由外界向硫酸厂供应能量,而且还可以由硫酸厂向外界输出大量能量。
(3)合理选择厂址,发展规模生产
化工厂厂址的选择是一个复杂的问题,它涉及到原料、水源、能源、土地供应、市场需求、交通运输、环境保护等因素,要综合考虑,权衡得弊,作出合理的抉择。
现代化工生产投资大,便于采用先进的技术以提高劳动生产率,同时有关“废热”利用、环境保护等辅助设施也便于处理。所以现代化工中规模越大,则单位产量的成本越低,经济效益越高。当然规模的大小还要根据国情而定。
1、硫酸工业
(1)硫酸的工业制法(接触法)
 系统地学习掌握某一物质的工业制法,一般要从所用原料、化学反应、适宜条件、生产过程、主要设备、环境保护等角度去分析理解。按照上述要求,工业上接触法制硫酸概括为“五个三”,即三种原料、三个反应、适宜生产条件的三个问题、三个生产过程、三个主要设备等。
系统地学习掌握某一物质的工业制法,一般要从所用原料、化学反应、适宜条件、生产过程、主要设备、环境保护等角度去分析理解。按照上述要求,工业上接触法制硫酸概括为“五个三”,即三种原料、三个反应、适宜生产条件的三个问题、三个生产过程、三个主要设备等。
二氧化硫的制取和净化:4FeS2+11O2 2Fe2O3+8SO2 (沸腾炉)

二氧化硫氧化成三氧化硫: 2SO2+O2 2SO3 (接触室)
三氧化硫的吸收和硫酸的生成:SO3+ H2O=H2SO4 (吸收塔)
(2)二氧化硫接触氧化反应适宜条件的选择
①催化剂:为了加快反应速率,工业上常选用V2O5作SO2氧化的催化剂。
②温度:从反应速率要求看,反应温度必须较高,从化学平衡要求看,反应温度必
须较低,结合催化剂的活性温度考虑,选择400 ℃~ 500 ℃作为SO2氧化的温度。
③压强:从反应速率要求看,理想压强应该较高,从化学平衡要求看,理想压强也
应较高,所以SO2氧化可以在压强很高的条件下进行。但常压下SO2的转化率已经较高,加压增大投资和能量消耗,因此SO2的氧化选择在常压下进行。
23.(10分)正以v=30m/s的速度运行中的列车,接到前方小站的请求:在该站停靠1分钟接一位危重病人上车,司机决定以加速度a1= 0.6m/s2匀减速运动到小站,停车1分钟后以a2 = 1.0m/s2匀加速起动,恢复到原来的速度行驶,试问由于临时停车共耽误了多少时间?
蓬街私立中学2009学年第一学期第一次月半考
22.(10分)汽车刹车后,停止转动的轮胎在地面上发生滑动,可以明显的看出滑动的痕迹,即常说的刹车线,由刹车线长短可以得知汽车刹车前的速度大小,因此刹车线的长度是分析交通事故的一个重要依据。某一特殊路段的最高限制速度为40km/h,有一辆汽车遇紧急情况刹车,若汽车刹车后以7 m/s2的加速度运动,刹车线长14m,假如你是一位交警,请你通过计算求出汽车刹车前的速度v0 ,,来判断卡车是否超速违章行驶?
21.(9分)为了测量一高楼的高度,有人设计了如下实验:在一根长为l的绳两端各拴一重球,一人站在楼顶上,手执绳的上端使小球与楼顶平齐并无初速释放,使其自由下落,另一个人在楼下测量两球落地的时间差△t,即可根据l、△t、g得出楼的高度(不计空气阻力).从原理上讲,这个方案是否正确?若测得l=10m,△t=0.4s,g=10m/s2,试估算楼的高度.
20.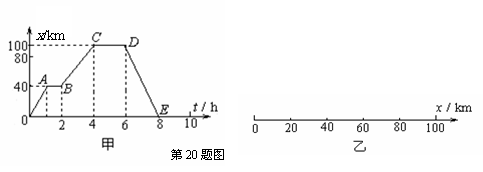 (9分)已知一汽车在平直公路上运动,它的位移一时间(x-t)图象如图(甲)所示.
(9分)已知一汽车在平直公路上运动,它的位移一时间(x-t)图象如图(甲)所示.



|
|


(1)根据图甲在图(乙)所示的位置坐标轴上标出A、B、C、D、E各点代表的汽车的位置;
(2)求出汽车在前8 h内的路程和位移大小.
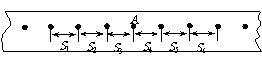
19.如图所示,某同学在做“研究匀速直线运动”实验中,由打点计时器得到表示小车运动过程的一条清晰纸带,纸带上两相邻计数点的时间间隔为T=0.10s,其中S1=7.05cm、S2=7.68cm、S3=8.33cm、S4=8.95cm、S5=9.61cm、S6=10.26cm,则A点处瞬时速度的大小是____________m/s,小车运动的加速度计算表达式为_______________,加速度的大小是_____________m/s2(计算结果保留两位有效数字).





18. 利用水滴下落可以测量出重力加速度g,调节水龙头,让水一滴一滴地流出.在水龙头的正下方放一盘子,调整盘子的高度,使一个水滴碰到盘子时,恰好有另一水滴从水龙头开始下落,而空中还有两个正在下落的水滴.测出水龙头处到盘子的高度为h(m),再用秒表测量时间,从第一滴水离开龙头开始,到第N滴水落至盘中,共用时间为T(s).当第一滴水落到盘子时,第二滴水离盘子的高度为______m,重力加速度g=______m/s2.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com