
17.(10分)已知可逆反应:M(g)+N(g)
 P(g)+Q(g)
△H>0
P(g)+Q(g)
△H>0
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1 ;达到平衡后,M的转化率为60%,此时N的转化率为 ;反应的平衡常数K=
(2)若反应温度升高,M的转化率
(填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)= a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=
; 
(4)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b mol·L-1,达到平衡后,M的转化率为
。(结果保留二位有效数字)
16.(16分)下图中A、B、C、D、E、F、G均为有机化合物。
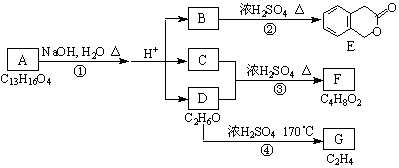

根据上图回答问题:
(1)D的化学名称是
。
(2)反应③的化学方程式是
。(有机物须用结构简式表示)
(3)B的分子式是
。
A的结构简式是
。反应①的反应类型是
。
(4)符合下列3个条件的B的同分异构体的数目有
个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途
。
15.(12分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=
。
 已知:
已知: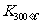 >
>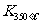 ,则该反应是 热反应。
,则该反应是 热反应。
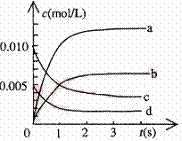
(2)右图中表示NO2的变化的曲线是
。
用O2表示从0~2s内该反应的平均速率v=
。
(3)能说明该反应已达到平衡状态的是
。
a.v (NO2)=2 v (O2)
b.容器内压强保持不变
c.v逆 (NO)=2 v正 (O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
14.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是

① 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
② 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量小
③ 甲烧杯中的酸过量
④ 乙烧杯中的酸过量
A.①③ B.①④ C.②③ D.②④
13.取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为
A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L
12.在0.1 mol·L‑1
CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+。对于该平衡,下列叙述正确的是
CH3COO-+H+。对于该平衡,下列叙述正确的是
A.加水,反应速率增大,平衡向逆反应方向移动
B.滴加少量0.1 mol·L‑1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 
C.加入少量NaOH固体,平衡向正反应方向移动,相对于原溶液pH减小
D.升高温度,电离程度增大,相对于原溶液pH减小
11.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
A.2mol C
B.2molA、1molB
C.1molB和1molC
D.2molA、3molB和3molC
10.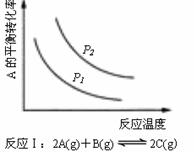 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强):
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强):

根据以上规律判断,下列结论正确的是

A.△H>0,P2<P1 B.△H<0,P2>P1
C.△H>0,P2>P1 D.△H<0,P2<P1
9. 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
 物质 物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
 下列说法错误的是:
( )
下列说法错误的是:
( )


 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
8.对于平衡 CO2(g) 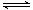 CO2(aq) △H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq) △H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
A.升温增压 B.降温减压 C.升温减压
D.降温增压
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com