
19.已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量)===A-+H2C- ②H2B(少量)+2A-===B2-+2HA
③H2B(少量)+H2C-===HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC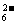 种离子中,最易结合质子的是
,最难结合质子的是
。
种离子中,最易结合质子的是
,最难结合质子的是
。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A.H3C+3A-===3HA+C3- B.HB-+A-===HA+B2-
C.H3C+B2-===HB-+H2C-
(4)完成下列反应的离子方程式。
A.H3C+OH-(过量) ;
B.HA(过量)+C3- 。
18. 某湿度下,纯水中的c(H+) =2×10-7mol/L,则此时c(OH-)=______,若温度不变,滴入稀硫酸使c(H+) =5×10-6mol/L,则c(OH-) =_______,由水电离出c(H+) 为 ,该纯水的PH值_______(填>、<、=)
17.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液 100 mL;②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
a.装HCl溶液的试管中放出H2的速率快; b.装HA溶液的试管中放出H2的速率快; c.两个试管中产生气体速率一样快:
(3)请你评价乙方案中难以实现之处和不妥之处。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
16.若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为 ( )
A.10:1 B.5:1 C.1:1 D.1:10
15.下列混合溶液中,各离子浓度的大小顺序正确的是
A.10 mL 0.1mol/L氨水与10 mL 0.1 mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,
c (Na+)=(Cl-) c (OH-)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
14.已知0.lmol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH-]+2 [A2-]
D.在Na2A溶液中一定有:[Na+]>[A2-]>[H+]>[OH-]
13.草酸是二元弱酸,草酸氧钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)<c(H2C2O4) D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
12.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
11.常温时,以下4种溶液pH最小的是 A.0.01mol ·L-1醋酸溶液 B.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积混合液 C.0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积混合液 D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
10.下列四种溶液中,由水电离出的c(H+)之比(依次)为( )
①pH=0的盐酸 ②0.1mol/L的盐酸 ③0.01mol/L的NaOH溶液 ④pH=11的NaOH溶液
(A)1 :10 :100 :1000 (B)0 :1 :12 :11
(C)14 :13 :12 :11 (D) 14 :13 :2 :3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com