
6、在密闭容器中盛有H2、O2、Cl2的混合气体通过电火花引燃,3种气体正好反应,
冷却至室温后,所得液体产物浓度为25.26%,则容器中原有H2、O2、Cl2的分子个数比是( )
A、6:3:1 B、9:6:1 C、13:6:1 D、10:6:1
5、氰气的化学式为(CN)2结构为N≡C-C≡N;其化学性质与卤素单质相似,下列叙
述中正确的是( )
A、(CN)2分子中C--C键的键长小于F--F键的键长
A、 氯化钠和氰化银均不溶于水
C、一定条件下,(CN)2可以和不饱和烃起加成反应
D、(CN)2和NaOH的反应可生成NaCN、NaOCN和H2O
4.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3), 碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
 KI+3H2O KIO3+3H2↑。下列有关说法正确的是
KI+3H2O KIO3+3H2↑。下列有关说法正确的是
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阴极反应是:I--6e- +3H2O=IO3-+6H+
C.当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g
D.电解前后溶液的pH减小
1、已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I- = 2Fe2+ + I2
2同温同压下,下列各组热化学方程式中,△H1<△H2是
A.S(g)+O2(g)=SO2(g); △H1 S(s)+O2(g)=SO2(g);△H2
B.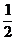 H2(g)+
H2(g)+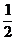 Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g); △H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g); △H2
C.2H2(g)+O2(g)=2H2O(g); △H1 2H2(g)+O2(g)=2H2O(l);△H2
D.C(s)+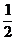 O2(g)=CO(g); △H1
C(s)+O2(g)=CO2(g); △H2
O2(g)=CO(g); △H1
C(s)+O2(g)=CO2(g); △H2
3阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是
A.1L 0.1 mol·L-1的FeCl3溶液中,Fe3+的数目约为6.02×1022
B.在标准状况下,2.24 L的CCl4中含有C-Cl键的数目约为0.4×6.02×1023
C.7.8 g Na2O2中含有的阴离子数目约为6.02×1022
D.0.1 mol NH2- 离子中所含的电子数约为6.02×1023
13.(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
|
(2)双氧水或过氧化氢;2KClO3====2KCl+3O2↑
14答案:(1)排除锌的颗粒大小、纯度等因素对化学反应速率的影响,使影响反应快慢的唯一因素是c(H+) 比较收集相同体积的H2所需时间(或比较相同时间内收集H2的体积)
15答案:⑴H2O Al(OH)3 (4分)
⑵Fe2++2ClO-+2H2O=Fe(OH)3↓+Cl-+HClO或2Fe2++2ClO-+2H2O+4OH-=2Fe(OH)3↓+Cl- 3ClO-+3H2O=Fe(OH)3↓+3HClO或Fe3++ 3OH-=Fe(OH)3↓)
课后练习
12.(1)2NaBr+Cl2=2NaCl+Br2 ;
(2)3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3) 5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O;(4)加入NaBr溶液。

13.现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。
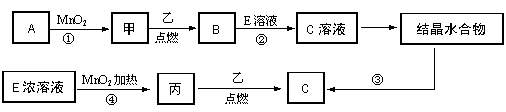
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则④的离子方程式
为 ;
(2)若反应①可在常温下进行,则A的名称是___________。若反应①需在加热条件下进
行,则反应的化学方程式为 。
14(8分)(1)取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是___________ _________________________________________________________________,比较生成H2快慢的方法是_______________________________________________________。
(2)做溴乙烷水解实验时,不断振荡溴乙烷与NaOH溶液混合物的作用是________
______________________________________,溴乙烷已完全水解的现象是________
_______________________________________________________________________
(2)增大溴乙烷与NaOH溶液的接触面积 将混合液静置看是否分层,若不分层说明溴乙烷已完全水解
15 (10分)⑴由短周期元素形成的难电离物质中,加酸或加碱都能抑制其电离的是___________(填化学式,下同),加酸或加碱都能促进其电离的是_______________。
⑵向FeCl2溶液和FeCl3溶液中分别加入NaClO、NaCl、NaOH混合溶液,结果都产生了红褐色沉淀,其可能的反应的离子方程式分别为:
FeCl2溶液中:________________________________________________________。
FeCl3溶液中:________________________________________________________。
课堂练习答案
11答案:+1 0 -1
H--O--F H2O2
(1) HFO+H2O=H2O2+HF
(2) H2O2+2H++2I-=I2+2H2O
5H2O2+2MnO4-+6H+=2M
12.工业上从海水中提取溴采用下列方法:
(1) 向海水中加入氯水使NaBr氧化,反应式为________________________。
(2) 向所得溶液中鼓入空气,将Br2吹出,用纯碱吸收生成的NaBr、NaBrO3 ,反应式为_____________________________。
(3) 将(2)所得溶液用硫酸酸化,使NaBr、NaBrO3转化为单质溴,反应式为____________________________________。
(4) 这样制得的溴含少量Cl2,除去Cl2的方法是_______________________。
10、溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为IBr+H2O=HBr+HIO下列有关IBr的叙述不正确的是( )
A、 IBr是共价化合物
B、 在很多反应中,IBr是强氧化剂
C、 IBr跟水反应时既不是氧化剂又不是还原剂
D、IBr跟NaOH稀溶液反应时,生成NaI、NaBrO、H2O
11长期以来一直认为氟的含氧酸不可能存在.但自1971年斯图杰尔和阿佩里曼(美)成功地制取了次氟酸后,这种论点被强烈地动摇了.他们是在00C下将氟从细冰末的上面通过,得到了毫克量的次氟酸.写出次氟酸的结构式,并标明各元素的化合价 .次氟酸很不稳定,刹那间就被热水所分解,此时得到的溶液,既表现有氧化性(对于NaI),又表现有还原性(对于酸性KMnO4)试推断次氟酸在水解时能生成什么产物?用化学方程式或离子方程式表示:
(1) 次氟酸水解的化学方程式
(2) 产物显示氧化性的离子方程式
(3) 产物显示还原性的离子方程式
9、实验室测量食盐中KI含量,常在一定条件下用过量溴水使KI变成碘,用煮沸法除去过量的溴避免干扰,再利用反应2Na2S2O3+I2=Na2S4O6+2NaI来分析碘的含量试回答:
(1)滴定时,选用的指示剂是( )
A、石蕊 B、酚酞 C、甲基橙 D、淀粉液
(2)假若溴大大过量时,宜用除去溴的正确方法是( )
A、加入过量AgNO3溶液 B、加入苯酚
C、加入足量KI D、加入溴化钾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com