
5.(银川市实验中学2009届高三年级第三次月考 )同温同压下,在4支相同体积的试管中分别充有等体积混合的2种气体,它们是:
①NO和NO2,②NO2和O2,③NH3和O2,④N2和H2现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3、V4,则下列关系正确的是 ( )
A、V1>V2>V3>V4 B、V4>V1>V3>V2
C、V2>V3>V4>V1 D、V4>V3>V1>V2
答案 B
4.(2008-2009学年度江苏省淮阴中学高三第三次调研测试).镁完全溶解于一定量浓硝酸反应,得到溶液A和NO2、N2O4、NO的混合气体,这些气体与2.24LO2(标准状况)混合后通入水中正好完全被水吸收。若向所得溶液A中加入NaOH溶液至恰好完全沉淀,将所得沉淀过滤洗涤灼烧至质量不再变化,此时固体量为
( )
A.16g B.8 g C.40g D. 0.2mol
答案 BD
3.(辽宁省沈阳二中2008-2009学年上学期高三期中考试)a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.①③ D.②④
答案 D
2.(浙江桐乡高级中学高三化学10月)将足量NH3通入HNO3和AgNO3的混合稀溶液中,生成沉淀的物质的量(n)和通入NH3的体积(V)的关系正确的是 ( )
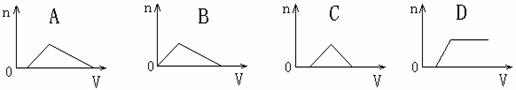
答案 A
1.(福建莆田四中09高三第二次月考)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为 ( )
A.2mol B.1 mol C.0.5mol D.0.25mol
答案 D
6. (湖南省长沙市一中2010届高三第四次月考)某活动小组利用右图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。
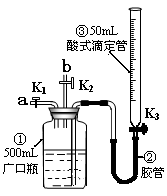 (1)向广口瓶①中通入NO并测定NO的体积
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作: ;
②从导管a通入一定量的NO,并记录滴定管液面变化的示数为VL
(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积
的主要操作: ;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可
观察到的现象是 ,写出对应现象的化学反应方程式 、 ;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i
当通入氧气的体积为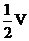 时,则广口瓶①的气体体积为
;
时,则广口瓶①的气体体积为
;
ii当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为 mol/L。
答案(1)①、 打开K2、K3(或K1、K3或K1、K2、K3均打开),
从滴定管加水,直到将①中空气全部排出(或者让水充满①)
且调节滴定管中液面与①相平并记录滴定管的刻度。
(其他合理答案也给分)
②、 关闭K2、打开K3、K1,
通入NO并调整滴定管液面与①中液面相平,
再次记录滴定管的刻度。
(第一步操作未打开或关闭,此空0分)
(2)①、气体先变为红棕色, (1分)
然后逐渐变淡。 (1分)
2NO + O2 = 2NO2 (2分)
3NO2 + H2O = 2HNO3 + NO (2分)
②、(1)V/3 (2分)
(2)V/11.2 mol/L
2009年联考题
5. 工业合成氨与制备硝酸一般可连续生产,流程如下:
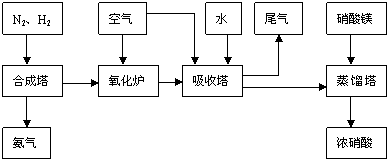
(1)工业生产时,制取氢气的一个反应为:CO+H2O CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系
中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)= 。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(2)合成塔中发生反应为:N2(g)+3H2(g)  2NH3(g);△H<0。右表为不同温度下该反
2NH3(g);△H<0。右表为不同温度下该反
应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
(3)NH3和O2在铂催化剂作用下从145℃就开始反应:
 4NH3+5O2
4NH3+5O2 4NO+6H2O
△H=-905kJ·mol-1
4NO+6H2O
△H=-905kJ·mol-1
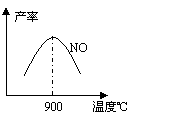
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________。
答案
4. (浙江省杭州学军中学2010届高三上学期期中考试) (1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为______________________________________ ;
②膦(PH3)在水中的溶解度远小于氨的原因是___________________________________。
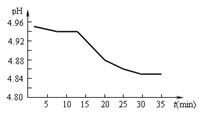 (2)SO2的排放是造成酸雨的主要因素。某地区酸雨
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨
pH随时间的变化如下图所示。请用化学方程式表
示该地区酸雨pH随时间增加而减小的原因:
。
(3)生活污水中含大量细小的悬浮物,可加入某些物
质使之聚集成较大的颗粒而沉淀。请你举一种常
见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含
大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4
+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为
两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)
ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
答案(1)①PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4 ②NH3能与水形成氢键而PH3不能 (2) (1)2H2SO3+O2=2H2SO4
(3)KAl(SO4)2·12H2O 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
(4)-1160 kJ·mol-1
3. (福建省三明一中2010届高三上学期期中考试)肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物等反应均可生成氮气和水,可以用作火箭燃料。请回答下列问题:
(1)写出肼与一氧化氮反应的化学方程式 。
(2)联氨溶于水显碱性,其原理与氨相似,但碱性不如氨水强,试写出其溶于水呈碱性
的离子方程式 。
(3)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 。
(4)如图是一个电化学装置示意图,用肼一空气燃料电池作此装置的电源。
①若A为粗铜(Fe、Ag、CO杂质),B为纯铜,C为CuSO4
溶液。
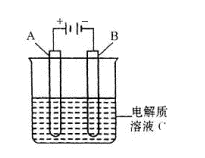 通电一段时问后,溶液中Cu2+的浓度将 (填
通电一段时问后,溶液中Cu2+的浓度将 (填
“增大”“不变”“减小”)
②若A为铂电极,B是石墨电极,c为硫酸,
则阴极的电极反应式为
。
利用该装置可制得少量过氧化氢,在阳极上SO42-被氧化成 S2O82-(过二硫酸根离子),
S2O82-与水反应即可生成H2O2:S2O82-+2H20=2 SO42-十H2O2+2H+
若要制取l moL H2O2,该燃料电池理论上需消耗 mol N2H4。
(5)火箭推进器中分别装有联氨和过氧化氢,它们发生反应时产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,另外还知:
H2O(1)= H2O(g) △H= +44 kJ·mol-1
2H2O2(1)= 2H2O(1)+O2(g) △H= -196.4 kJ·mol-1
写出联氨与氧气反应生成液态水的热化学方程式为 。
答案(1)N2H4+2NO=2N2+2H2O(2分)
(2)N2H4+H2O N2H5OH
N2H5OH 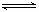 N2H5+
+OH--(2分)
N2H5+
+OH--(2分)
(3)O2+4e-+2H2O = 4OH--(2分)
(4)①减小(1分) ②2H++2e - = H2↑ (1分) 0.5(2分)
(5)N2H4(1)+O2(g)=N2(g)+2H2O(1) △H=-621.23kJ·mol-1(2分)
2. (浙江省杭州学军中学2010届高三上学期期中考试)下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
(浙江省杭州学军中学2010届高三上学期期中考试)下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是
(2)若装置中缺B,其后果是 。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是 。
(4)C装置的作用是 ; E中a仪器所起的作用是 。
答案(1)排除装置内的空气,防止生成的NO被空气中的O2氧化
(2)在C中水蒸气被冷却水,它与NO2或N2O4反应生成NO,干扰NO的验证
 (3)因有2NO+O2
(3)因有2NO+O2 2NO2,所以气体由无色变为红棕色。升高温度,2NO2
N2O4
的平衡向在移动,NO2的物质的量增大,颜色加深
(4)把NO2全部转化为N2O4晶体,避免在D装置中对NO的验证产生干扰,防止倒吸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com