
3.化学平衡移动的限度问题:新的平衡值总是介于原平衡值和突变值之间
2.影响化学平衡的因素
(1)浓度: ① 固体量的多少对平衡没有影响
② 离子反应只有改变参与反应的离子浓度才会影响平衡
③ 增加一个反应物的浓度能增大其他反应物的转化率,而其本身的转化率则减小。
(2)压强: ① 压强仅对气体反应的平衡有影响。而且对气体体积相同的反应的平衡无影响。
② 若在平衡体系中充入稀有气体
在等温等容条件下,对平衡无影响
在等温等压条件下,使平衡向气体体积扩大方向移动
(3)温度:
(4)催化剂: ① 催化剂通过参与反应改变化学反应途径加快化学反应速率
② 催化剂在化学反应前后质量保持不变
③ 催化剂中毒
注意:(1)不要把化学平衡的移动和反应速率变化混为一谈
(2)不要把化学平衡的移动和常衡常数K值变化混为一谈
1.平衡移动方向的确定:根据条件改变时,v正’和v逆’的相对大小
(1)条件改变时, 若v正’>v逆’,平衡向正反应方向移动
若v正’<v逆’,平衡向逆反应方向移动
若v正’=v逆’,平衡不移动
(2)勒沙特列原理:改变影响化学平衡的一个条件,平衡总是向减弱这种改变的方向移动。
3.化学平衡常数:生成物系数次方的乘积比上反应物系数次方的乘积
注意:①一个反应的化学平衡常数只与温度有关,与浓度、压强等无关。(温度升高,K值如何变化?)
②平衡常数反映了反应进行的程度,不表示速率的快慢,(不能说K越大,反应速率越快),一定温度下,K越大,说明反应进行的越完全。
③对固体或纯液体,浓度视为常数。
④平衡常数的表达式与化学方程式的书写有关:如:N2+3H2 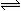 2NH3 K1=__________
2NH3 K1=__________
2NH3
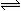 N2+3H2 K2=__________;1/2N2 + 3/2H2
N2+3H2 K2=__________;1/2N2 + 3/2H2 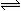 NH3 K3=___________
NH3 K3=___________
K1与K2的关系为______________;K1与K3的关系为_______________。
2.平衡状态的判断
①同种物质的V正=V逆
②各组分的浓度(或百分含量或体积分数)保持不变(注意非相等或与系数成比例
③压强:等体反应_________ 非等体反应_________
恒容时气体密度:全部为气体物质_________ 部分为气体物质_________
气体的平均分子量:
体系的颜色: (体系的颜色变化是否一定有平衡的移动?)
1.化学平衡状态
(1)概念:化学平衡状态是指一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
(2)特征:逆、等、动、定、变
2、反应方向的判断:ΔH<0、ΔS>0:反应自发进行
ΔH>0、ΔS<0:反应不自发
ΔH>0、ΔS>0:高温为自发
ΔH<0、ΔS<0:低温下自发
注意:①自发反应不一定在任何条件下都能发生,有些自发反应需要在一定条件下才能发生。
非自发反应并不是一定不能反应,在一定条件下,非自发反应也可能发生(如电解)
②反应的自发性只能用于判断反应的方向,不能确定反应是否一定发生或发生的速率的大小。
1、 反应方向的判据:能量判据:能量从高到低,焓变ΔH<0
熵变判据:混乱度:从有序到无序,熵变ΔS>0
(熵变从小到大的过程:S→l→g;固体溶解;气体分子数增多)
3.影响化学反应速率的因素
影响速率的因素有内部与外部因素,内因由参加反应的物质的性质决定,是主要因素。
外部因素:当反应一定时,外部因素对反应的影响。
(1)浓度:其它条件不变时,增大反应物(或生成物)浓度,可以增大反应速率。(从微观上看是单位体积内活化分子个数增多)
注意:①对固体,反应速率与其表面积大小有关,一般认为其浓度为一常数,它的量的多少对速率无影响,但固体颗粒大小对反应速率有影响。纯液体浓度也可看成是一常数。
②对可逆反应而言,在增大反应物浓度的瞬间,v正突然增大后减小,v逆不变后增大
(2)温度:其它条件不变时,升高温度可以加快反应速率;降低温度可以减小反应速率。(从微观上看是增大了活化分子百分数)
注意:① 一般温度每升高10℃,反应速率增大为原来的2-4倍。
② 对可逆反应而言,升高温度可使正逆反应速率同时增大,但吸热方向速率增大的倍数更大。
(3)压强:对于有气体参加的反应,其它条件不变时,增大压强可以增大反应速率;减小压强,可以减小化学反应速率。(从微观上看是增大了单位体积内的活化分子个数)
注意:①对可逆反应而言,增大压强可同时增大正逆反应速率,但气体体积缩小方向的速率增大的倍数更大。
(4)催化剂:使用合适催化剂能同等程度地影响正逆反应速率。(不会导致化学平衡的移动。)(从微观上看是增大了活化分子百分数)
注意:①催化剂增大化学反应速率的原因是催化剂通过参与化学反应,改变了化学反应途径,(降低了反应的活化能)使化学反应速率加快。催化剂本身在反应前后质量保持不变。
②酶的催化作用:
(5)其他:如:颗粒纯度:与稀酸反应,粗锌比纯锌快(形成原电池);激光、射线、超声波、紫外线等。
二:化学反应的方向:
2.有效碰撞
(1)有效碰撞是指能发生化学反应的碰撞,发生有效碰撞的分子具有足够的能量,且具有合适的取向。
(2)活化分子是指有可能发生有效碰撞的分子。活化分子的能量比反应物分子的平均能量高。
(3)活化能:活化分子的平均能量与所有分子的平均能量之差称为活化能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com