
(二)物质的量守恒
在大多数资料中,对物质的量守恒描述的并不多,其实我们最常遇到的元素守恒就隶属于其中。当然还有涉及宏观(具体)物质的守恒。
1.涉及宏观(具体)物质的守恒
例6:质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液n g混合后,蒸发掉pg水。得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)
g混合后,蒸发掉pg水。得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)
A.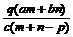 B.
B.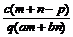
C.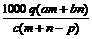 D.
D.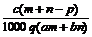
解析:根据溶质的物质的量守恒可得: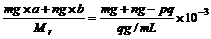 L/mL×cmol/L,整理得:
L/mL×cmol/L,整理得: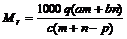 g/mol,故选C。
g/mol,故选C。
2.元素守恒
实际上,元素守恒也含有质量守恒的意思,只不过在具体应用时,很少直接用其质量而是用其物质的量(或粒子个数)。元素守恒又可分为原子守恒和离子守恒,但原子守恒和离子守恒并没有严格意义上的区分,只是由于在不同情境中呈现的形态不同而已,多数情况下,常笼统地称作元素守恒。
(1)原子守恒
例7:某温度下,1L密闭容器中加入1molN2和3molH2,使反应
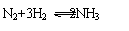 达到平衡。测得平衡混合物中N2、H2、NH3的物质的量分别为M、N、Q。如果温度不变,只改变初始物质的加入量,而要求M、N、Q维持不变,则N2、H2、NH3的加入量用x、y、z表示时,应满足条件:
达到平衡。测得平衡混合物中N2、H2、NH3的物质的量分别为M、N、Q。如果温度不变,只改变初始物质的加入量,而要求M、N、Q维持不变,则N2、H2、NH3的加入量用x、y、z表示时,应满足条件:
(1)若x=0,y=0,则z= 。
(2)若x=0.75mol,则y= , z= 。
(3)x、y、z应满足的一般条件是(用含x、y、z的方程式表示) 。

例8:将amolH2S和1molO2置于一个容积可变的容器内进行反应。维持容器内气体的压强不变(101kPa),在120℃下测得反应前后容器内气体的密度分别为d1和d2。若a的取值不同,则H2S的氧化产物可能有如下三种情况:
(1)全部是SO2,此时a的取值范围是 。
(2)全部是S,此时a的取值范围是 ,d1 d2(填大于、小于或等于)。
(3)部分是SO2,部分是S,此时a的取值范围是 ,反应所生成的SO2的物质的量为 mol,容器内气体的物质的量之和为 mol。(以含a的代数式表示)
解析:n(O2)=1mol,设生成SO2为xmol,S为ymol,H2O为zmol。直写方程式:aH2S+[1]O2=xSO2+yS+ zH2O(g)。
(1)若y≤0,则全部生成SO2:

解得a=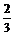 ,即a的取值范围是:a≤
,即a的取值范围是:a≤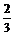 。
。
(2)若x≤0,则全部生成S:

解得a=2,即a的取值范围是:a≥2。
(3)若x>0,y>0,则产物中既有SO2 ,又有S:
,又有S:
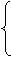
|
|
|||
|
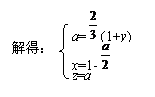
因为y>0,从(2)可知y≤2,所以a的取值范围是: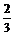 <a<2。
<a<2。
反应后,SO2的物质的量为(1-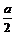 )mol,容器内气体的物质的量之和为:x+z=(1+
)mol,容器内气体的物质的量之和为:x+z=(1+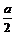 )mol。
)mol。
 例9:将2molH2O和2molCO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
例9:将2molH2O和2molCO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=amol,n(CO2)平=bmol。试求n(H2O)平= 。(用含a、b的代数式表示)
 (2)由O原子守恒可知,由CO生成CO2分子内增加的O原子来源于H2O,另外O2中的O原子也来源于H2O。因此,n(H2O)反应=2×n(O2) +1×n(CO2)=2×amol+1×bmol=(2a+b)mol。
(2)由O原子守恒可知,由CO生成CO2分子内增加的O原子来源于H2O,另外O2中的O原子也来源于H2O。因此,n(H2O)反应=2×n(O2) +1×n(CO2)=2×amol+1×bmol=(2a+b)mol。
n(H2O)平=2mol-(2a +b)mol=(2-2a-b)mol。
+b)mol=(2-2a-b)mol。
(2)离子守恒
例10:向含0.01mol AlCl3的溶液中逐滴加入34mL 1mol/L NaOH溶液,则生成物及其物质的量分别为 。
解析:n(NaOH):n(AlCl3)=0.034mL×1mol/L:0.01mol=3.4:1(或17:5),大于3小于4,故生成物中既有Al(OH)3,又有NaAlO2。设生成的Al(OH)3的化学计量数为x,NaAlO2的化学计量数为y。直写方程式:
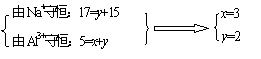 5AlCl3+17NaOH=xAl(OH)3↓+yNaAlO2+15NaCl+
5AlCl3+17NaOH=xAl(OH)3↓+yNaAlO2+15NaCl+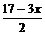 H2O
H2O
则n[Al(OH)3]=0.006mol,n(NaAlO2)=0.004 mol, n(NaCl)= 0.003mol。
(3)原子、离子并存守恒(元素守恒)
例11:将一定质量的镁、铝合金投入100mL一定浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示。由图中数据分 析计算:
析计算:

(1)原合金中镁、铝的质量;
(2)盐酸的物质的量浓度。
解析:由图可知:Mg(OH)2的质量为11.6g,Al(OH)3的质量为19.4g-11.6g=7.8g。

(2)当V(NaOH,aq) =160mL时,Mg2+、Al3+完全沉淀,此时溶液为NaCl溶液,由Cl-离子、Na+离子守恒可知:
=160mL时,Mg2+、Al3+完全沉淀,此时溶液为NaCl溶液,由Cl-离子、Na+离子守恒可知:
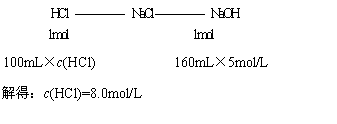
例12:向300mL KOH溶液中缓慢通入2.24L CO2气体(标准状况),充分反应后,在减压低温下蒸发溶液,得到11.9g白色固体。 请通过计算确定此白色固体的组成及其质量各为多少克?所用KOH溶液的物质的量浓度是多少?
请通过计算确定此白色固体的组成及其质量各为多少克?所用KOH溶液的物质的量浓度是多少?
解析:先由极端假设法确定白色固体的组成:设定2.24L CO2与KOH溶液反应所得产物只有一种,即K2CO3或KHCO3。若只生成K2CO3,由C原子守恒可求得m(K2C O3)=
O3)=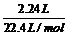 ×138g/mol=13.8g;若只生成KHCO3,由C原子守恒可求
×138g/mol=13.8g;若只生成KHCO3,由C原子守恒可求 得m(KHCO3)=
得m(KHCO3)=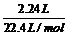 ×100g/mol=10.0g。而题设质量为11.9g,故该白色固体由K2CO3和KHCO3组成。由C原子守恒可得:n(CO2)=
×100g/mol=10.0g。而题设质量为11.9g,故该白色固体由K2CO3和KHCO3组成。由C原子守恒可得:n(CO2)=
n(K2CO3)+n(KHCO3)=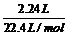 =0.100mol。设K2CO3的物质的量为amol,则KHCO3的物质的量为0.100mol-amol。则由138g/mol×amol+100g/mol×(0.100mol-amol)=11.9g,解之得:a=0.050mol。
=0.100mol。设K2CO3的物质的量为amol,则KHCO3的物质的量为0.100mol-amol。则由138g/mol×amol+100g/mol×(0.100mol-amol)=11.9g,解之得:a=0.050mol。
所以m(K2CO3)=0.050mol×138g/mol=6.90g, m(KHCO3)=0.050mol×100
g/mol=5.00g。
由K+离子守恒可得:n(KOH)=2×n(K2CO3)+1×n(KHCO3)= 2×0.050mol+1×0.050mol=0.150mol。
所以c(KOH)=n(KOH)/V=0.150mol/0.300L=0.50mol/L。
(4)质子守恒
一般情况下,很少单独考虑质子守恒,实际上在盐(水)溶液中存在的质子守恒可看作是物料守恒与电荷守恒(后面将要涉及到)的叠加项。
所谓的质子守恒,实质是从水的电离出发,考虑弱酸根离子结合水电离出的H+或弱碱阳离子结合水电离出的OH-,然后在溶液中寻找H+和OH-的“藏身”之所,而列出的等式关系。常用于盐溶液中粒子浓度关系的比较。
下面以Na2CO3溶液、NH4Cl溶液和(NH4)2CO3溶液为例,来确定它们的溶液中各自存在的质子守恒关系。
Na2CO3溶液:在不考虑CO32-水解时,水电离出的H+与OH-的物质的量是相等的,但当CO32-水解结合部分水电离出的H+后,分别生成了HCO3-(结合一个H+)和H2CO3(结合两个 H+),而OH-未被消耗,因此可列出等式关系:c(OH-)=c(H+)+c(HCO3-)+2×c(H2CO3),即Na2CO3溶液中的质子守恒。
H+),而OH-未被消耗,因此可列出等式关系:c(OH-)=c(H+)+c(HCO3-)+2×c(H2CO3),即Na2CO3溶液中的质子守恒。
NH4Cl溶液:同理,NH4+水解结合的是由水电离出的部分OH-,生成了NH3·H2O,而H+未被消耗,因此可列出等式关系:c(H+)=c(OH-)+c(NH3·H2O),即为NH4Cl溶液中的质子守恒。
(NH4)2CO3溶液:NH4+水解结合的是由水电离出的部分OH-,生成了NH3·H2O;CO32-水解结合部分水电离出的H+,分别生成了HCO3-和H2CO3,H+、OH-都有一部分被消耗,分别寻找H+、OH-在溶液中的“藏身”之所,即可列出下列等式关系:
c(H+)+c(HCO3-)+2×c(H2CO3)=c(OH-)+c(NH3·H2O),即为(NH4)2 CO3溶液中的质子守恒。
CO3溶液中的质子守恒。
体积守恒
利用体积守恒的题目相比较而言要少一些,实际上它仍隶属于物质的量守恒。化学平衡中会经常遇到反应前后体积守恒的题目,并用于判断和计算,只不过通常情况下不从守恒角度去认识罢了。
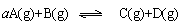 例13:在t℃时,向一密闭容器中充入2mol A和3mol B,发生如下化学反应:
,平衡后测得各物质浓度有如下关系:ca(A)·c(B)=c(C)·c(D)。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终不变,则这时B的转化率为( )
例13:在t℃时,向一密闭容器中充入2mol A和3mol B,发生如下化学反应:
,平衡后测得各物质浓度有如下关系:ca(A)·c(B)=c(C)·c(D)。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终不变,则这时B的转化率为( )
A.60% B.40% C.20% D.无法确定
(一)质量守恒
在此探讨的质量守恒,已不再是狭义的质量守恒定律,它涵盖了物理和化学两种变化中的有关守恒关系。
1.固态混合物
由固体物质组成的混合物,往往在化学变化前后存在某一方面的守恒因素,利用这些因素可省时省力。
例1:取一定量的KClO3和MnO2的混合物共热制取O2,反应开始时MnO2在混合物中的质量分数为20%,当反应进行到MnO2在混合物中的质量分数为25%时,求KClO3的分解百分率。
解析:MnO2在反应中作催化剂,反应前后质量守恒。设原混合物的质量为m1g,反应结束后混合物的质量为m2g,则MnO2反应前后的质量分别为:0.2m1g和0.25m2g。由MnO2的质量守恒可得:0.2m1g=0.25m2g,m2=0.8m1。由反应前后质量守恒可知,放出O2的质量应等于反应前后的固体质量之差,即:m1g-m2g=m1g-0.8m1g=0.2m1g。即可求得KClO3的分解百分率为: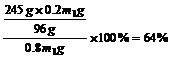 。
。
2.溶液
对溶液而言,可以从其组成上,即浓度(质量分数)、溶剂和溶质三方面去寻找内含的某些守恒因素,用于解决有关溶液计算的问题。
(1)浓度守恒
例2:某盐的饱和溶液的质量分数为26.8%,取一定量的此饱和溶液,加入wg该无水盐,在温度不变的情况下,析出mg含有一定量结晶水的该盐晶体,则从饱和溶液中析出溶质的质量为
A.26.8%w B.m-w
C.(m+w)×26.8% D.( m-w)×26.8%
解析:由于温度不变,析晶后,剩余溶液、减少的溶液(m-w)及原溶液浓度(质量分数)守恒,故有(m-w)×26.8%,答案应选D。
(2)溶剂守恒
例3: 在一定温度下,向55.3g蒸馏水中加入一定量的无水Na2SO3粉末,充分搅拌后过滤,得到60g滤液和一定量的Na2SO3·7H2O晶体,若此温度下Na2SO3的溶解度为20g,求析出的Na2SO3·7H2O晶体的质量。
解析:解此题的关键是:溶剂水的质量守恒。析晶后,原溶剂水分成了两部分,即所得饱和溶液中的水和析出晶体中的结晶水。若设析出晶体的质量为xg。则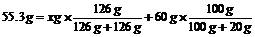 ,解得:x=10.6g。
,解得:x=10.6g。
(3)溶质守恒
例4:将某二价金属R的单质粉末投入到200mL浓度为1mol/L的H2SO4溶液中,待完全反应后滤去过量的金属粉末,蒸发溶液到剩余84g时,保持温度为t℃,开始析出RSO4·7H2O晶体。在该温度下继续蒸发,当析出20.5g晶体时,还留下49g溶液。求金属R的相对原子质量。
解析:由题意可知,84g溶液和49g溶液皆为t℃时的饱和溶液。设RSO4的摩尔质量为M,RSO4在t℃时的溶解度为Sg。由溶质的质量守恒可得:
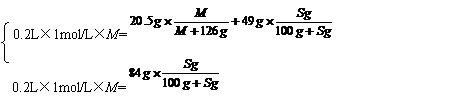
解方程组得:S=40,M=120g/mol
所以,金属R的相对原子质量为:120-96=24。
3.其它
有些混合体系中,不同形态的物质(如气态和固态或液态,固态和液态等)之间往往会存在某种形式的守恒量,利用这些量之间的守恒关系,可使问题得以简化。
例5:向一定量的NaOH固体中加入由硫酸铜和硫酸组成的混合物的溶液,充分搅拌,恰好完全反应,有蓝色沉淀生成,过滤,所得滤液的质量与加入的原混合物溶液的质量相等。则与硫酸铜反应的氢氧化钠和与硫酸反应的的氢氧化钠的物质的量之比为 。
解析:此题属于一道典型的无数据计算题。依题意不难分析出其中的守恒关系,即m(NaOH)=m[Cu(OH)2]。设与CuSO4反应的NaOH为xmol,与H2SO4反应的NaOH为ymol,则由(xmol+ymol)×40g/mol=98g/mol×(xmol×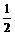 ),
),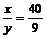 。
。
所谓“物料”,就是物质。从物质的形态而言,有宏观意义上的物质,又有微观意义上的粒子。当谈到“物料”守恒时,对宏观物质而言,主要是质量守恒;对微观粒子而言,则主要是与物质的量挂钩的元素守恒。
32.读“某城镇工业布局简图”回答以下问题:(24分)

(1)计划在城市建设电子工业基地、饮料厂、钢铁厂、化工厂,请在下表中按要求填上适当内容
|
工 厂 |
序号 |
布局理由 |
|
电子工业 |
|
|
|
饮料厂 |
|
|
|
钢铁厂 |
|
|
|
化工厂 |
|
|
(2)该城市工矿企业和汽车等交通工具排放物中,含有大量的煤烟、粉尘、 化合
物、 化合物等有害物质,严重污染了环境。
(3)为将“三废”实行有效处理,化害为利,可在有色金属冶炼厂附近再建一座
厂,火电厂附近应建的工厂是 。
31.读下图,回答问题:(16分)

(1)嘉陵江与长江交汇处的城市是 ;
(2)图中城市的区位选择反映我国南方城市分布的一般规律是_____ ___。在我国,与该城区位类型一致的还有长江沿岸的____ ___等城市。
(3)该城市发展的自然区位因素是:① ;
② ;③ ;
(4)该城市发展的区位因素与工业发展的区位因素的相同点是:① ;
② ;
30.城市垃圾处理的最优方式应为:( )
A.以掩埋为主 B.以焚烧为主
C.用垃圾作为能源发电及综合处理 D.用巨轮运到大洋中投入深海
29.下列几种经济发展模式中,正确的是:( )
A.追求利润----盲目发展----损害环 B.先发展----后治理----再积累
C.先积累----后发展----再治理 D.边发展----边积累----边治理
28.我国战国时期的孟轲,在《孟子••公孙丑》中提出了“天时不如地利,地利不如人和”,其体现了人地关系的何种思想
A、地理环境决定论 B、人定胜天论 C、可持续发展论 D、天人相关论
27.人类认识环境是一个漫长的历史过程,主要围绕着( )进行。
A.生产力的发展 B.人类文明发展
C.知识的积累 D.工业的推进,科技进步
26.随着人类文明的演变,人地关系的认识水平也在变化。下列关于不同时期人地关系思想的叙述,正确的是 ( )
A.采猎文明时期--改造自然 B.工业文明时期--崇拜自然
C.农业文明时期--征服自然 D.现代文明时期--谋求人地协调
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com