
7、下列关于电场强度、电势、电容量、磁感应强度的计算公式中属定义式一组是:
A.E=F/q φp=Ep/q
B.B=F/IL C=Q/U
C.E=KQ/R2 B=Φ/S
D.E=U/d C=εS/4πkd
6、一个点电荷从静电场中的a点移到b点,其电势能的变化为零,则
A.a b两点的场强一定相等
B.电荷由a点移到b点电场力做的功一定为零
C.作用于该点电荷的电场力与移动方向总是垂直的
D.a、b两点的电势一定相等
5、安培分子电流假说可用来解释
A、运动电荷受磁场力作用的原因 B、两通电导体有相互作用的原因
C、永久磁铁具有磁性的原因 D、软铁棒被磁化的现象
4、下列关于电动势的说法中错误的是:
A、外电路断开时路端电压等于电源电动势
B、外电路短路时路端电压等于电源电动势
C、电动势是用来比较电源将其它形式的能转化为电能本领大小的物理量
D、电源电动势等于电源内阻上的电压与外电阻上的电压之和
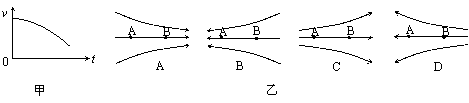
3、A、B是一条电场线上的两个点,一带负电的微粒仅在电场力作用下以一定初速度从A点沿电场线运动到B点,其速度-时间图像如图甲所示。则这一电场可能是图乙中的
2、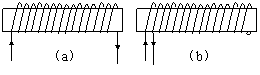 取两个粗细、材料完全相同的长导线,用其中一根绕成如图(a)所示的螺线管,当该螺线管中通以电流强度为I的电流时,测得螺线管内中部的磁感应强度大小为B,若将另一根长导线对折后绕成如图(b)所示的螺线管,并通以电流强度也为I的电流时,则在螺线管内中部的磁感应强度大小为
取两个粗细、材料完全相同的长导线,用其中一根绕成如图(a)所示的螺线管,当该螺线管中通以电流强度为I的电流时,测得螺线管内中部的磁感应强度大小为B,若将另一根长导线对折后绕成如图(b)所示的螺线管,并通以电流强度也为I的电流时,则在螺线管内中部的磁感应强度大小为
A.0 B.0.5B
C.B D.2 B
1、磁体之间的相互作用是通过磁场发生的。对磁场认识正确的是
A.磁感线有可能出现相交的情况
B.磁感线总是由N极出发指向S极
C.某点磁场的方向与放在该点小磁针静止时N极所指方向一致
D.若在某区域内通电导线不受磁场力的作用,则该区域的磁感应强度一定为零
18、在25℃时,
(1)把1mL0.05mol/L的H2SO4溶液稀释到原来体积的100倍,求此时溶液的PH;
(2)在上述溶液中加入PH=12的NaOH溶液多少mL刚好使溶液的PH=7?
15(16分)、25℃时,将0.1molCH3COONa和0.05molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①
②
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.1mol/L的是 ,浓度为0.05mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.1mol。
16(12分)、某学生用中和滴定法测定某烧碱的纯度。实验如下:
(1)配制待测液:用已经称好的5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制成1000mL的溶液,除烧杯外,还需要的玻璃仪器有 (填序号)。
①天平、②蒸发皿、③玻璃棒、④100mL容量瓶、⑤1000mL容量瓶、⑥胶头滴管、⑦试管
(2) 用标准 0.10 mol/L的盐酸溶液滴定NaOH溶液的实验操作如下:
A.用碱式滴定管取稀NaOH溶液 20 .00mL,注入锥形瓶中,加入甲基橙指示剂。
B.用待测定的NaOH溶液润洗碱式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2-3 cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶装稀NaOH溶液,重复滴定操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用字母序号填写):()→()→()→()→D→()→()。
②滴定时 手旋转酸式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴入一滴标准盐酸时溶液立即由 色变成 色, 且半分钟内不变色,则达到滴定终点。
(3)酸式滴定管用蒸馏水洗后,未用标准液润洗,导致滴定计算结果NaOH溶液浓度(填“偏小”、“偏大”或“无影响”,下同) ;酸式滴定管读数时,若先俯后仰,则计算结果NaOH溶液浓度会 。装NaOH溶液的锥形瓶中原来有少量水则结果会 。
17(10分)、从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10-9 |
6.8×10-6 |
5.5×10-6 |
1.8×10-11 |
(1)在从海水中提取镁时,首先要把海水中的镁离子转化为沉淀,往往用到贝壳(主要成份是碳酸钙),如果将贝壳研磨成粉末直接投入浓缩的海水中,你认为 (填“能”或“不能”) 将镁离子转化为MgCO3沉淀;如果不能直接投入,应将贝壳作何处理 (如前面选“能”,此处不用回答)。
(2)某同学在实验室条件下模拟该生产过程,他打算用烧碱把海水中的镁离子转化为沉淀。在加试剂时,他误将纯碱溶液加入海水中,他思考了一下,又在得到的混合液中加入过量的烧碱溶液,你认为他最终得到的沉淀是 ,实验过程所发生反应的离子方程式为 。
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的PH最低应为 。
14、在1L0.3mol·L-1的NaOH溶液中,通入标准状况下的4.48LCO2,完全反应后,下列关系式正确的是
A.c(Na+)>c(OH-)>c(CO32-) >c(HCO3-) >c(H+)
B.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com