
14.pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX一定是弱酸 B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是强酸 D.反应开始时二者生成H2的速率相同
13.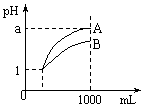 室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.稀释后,a可能大于4。
12.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.HCO3- 既是酸又是碱,NH3既不是酸又不是碱
B.ClO-+H2O HClO+OH-是酸碱反应
HClO+OH-是酸碱反应
C.2Na+2H2O = 2NaOH+H2↑是酸碱反应
D.碱性强弱顺序为:C2H5O- > OH- > C6H5O-
11.将pH=3的盐酸aL分别与下列三种溶液混合后,溶液均呈中性:
① 1×10-3mol/L 的氨水bL ②c(OH-)=1×10-3mol/L 的氨水cL
③ c(OH-)=1×10-3mol/L 的Ba(OH)2溶液dL
其中a、b、c、d的关系正确的是
A.b>a>d>c B.b>a=d>c C.a=b>c>d D.c>a=d>b
10.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y―>CO32―>X―>HCO3―
C.溶液物质的量浓度相同时碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(X―)>c(Na+)>c(HCO3―)>c(OH―)
9.下列实验不能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定同浓度Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
8.甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
7.
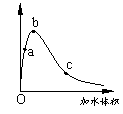 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
6.已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A .加少量烧碱溶液 B .升高温度 C .加少量冰醋酸 D .加水
5.对氨水溶液中存在的电离平衡NH3·H2O NH4++OH-分析,下列叙述正确的是
NH4++OH-分析,下列叙述正确的是
A.加水后,溶液中n(OH–)增大
B.加入少量浓盐酸,溶液中n(OH–)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)减少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com