
23.(12分)向浓度相同、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。
(1)在稀释后的A、B溶液中分别逐滴加入0.1mol·L-1的盐酸,产生的CO2体积(标准状况)与所加盐酸的体积关系如下图所示。
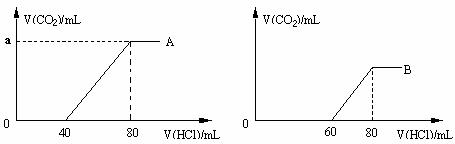
① A曲线表明,在NaOH溶液中通入一定量CO2后,溶液中溶质是
(填化学式), a值为 (标准状况)。
② B曲线表明,当0<V(HCl)≤60时,涉及反应的化学方程式为 。
(2)原NaOH溶液的物质的量浓度为_________mol·L-1,B溶液最多还能吸收CO2体积为  (标准状况)。
(标准状况)。
22.(14分 )由两种固体组成的混合物A可以发生如下框图所示的一系列变化。
)由两种固体组成的混合物A可以发生如下框图所示的一系列变化。
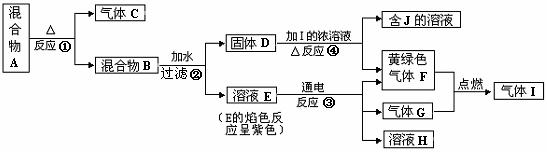
(1)按要求写方程式:
反应①的化学方程式 ;
反应③的离子方程式 ;反应④的离子方程式 ;
(2)根据下图回答问题:
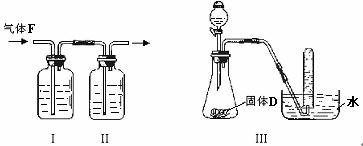
①在实验室中要获得干燥纯净的黄绿色气体F,可以将它通过如图I、II所示的装置,其中瓶I中盛放的是 ,目的是 ;
②用图III装置制取并证明气体C,分液漏斗内盛放的液体是 ,试管中收集满气体后,下一步实验操作是: 。
21.(12分)
(I)将1molI2(g) 和2molH2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);
2HI(g); H<0。2min时,测得I2的物质的量为0.6mol。10min后达到平衡,HI的体积分数
H<0。2min时,测得I2的物质的量为0.6mol。10min后达到平衡,HI的体积分数 随时间变化如下图中曲线II所示。
随时间变化如下图中曲线II所示。
请回答下列问题:
(1)前2min内,用H2表示的平均反应速率为
mol·L-1·min-1。
(2)达到平衡时,I2(g)的物质的量浓度为 mol·L-1。
(3)若改变反应条件,在某条件下 的变化如 上图曲线I所示,则该条件可能是
的变化如 上图曲线I所示,则该条件可能是
(填入下列条件的序号)
①恒容条件下,升高温度
 ②恒容条件下,降低温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器的体积 ④恒温条件下,扩大容器的体积
⑤恒温恒容条件下,加入适当的催化剂
(II)有下图所示的装置:
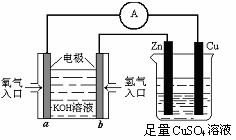
(1)该装置中铜片电极名称为 极,b极的电极反应式为 。
(2)当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为 L。
20.(10分)已知三角锥形 分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图
分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图
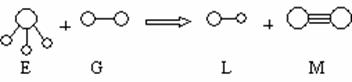
回答下列问题:
(1)M的电子式 。
(2)E是由 键构成的 分子(填“极性”或“非极性”)。
(3)组成G 的元素在周期表中的位置
。
的元素在周期表中的位置
。
(4)上述反应中氧化剂与还原剂的物质的量之比为 。
19.(8分)根据水在化学反应中的作用,按要求完成下列氧化还原反应的化学方程式:
(1)水只作氧化剂:
(2)水只作还原剂:
(3)水既作氧化剂,又作还原剂:
(4)水既不作氧化剂,又不作还原剂:
18.2008年北京奥运会“祥云”奥运火炬所用环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5 kJ·mol-1;正丁烷的燃烧热为:2878kJ·mol-1;异丁烷的燃烧热为:2869kJ·mol-1。下列有关说法正确的是
A.丙烷燃烧的热化学方程式可表示为:
C3H 8(g)+5O2(g)=3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
8(g)+5O2(g)=3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
B.正丁烷燃烧的热化学方程式可表示为:
2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);ΔH= -2878 kJ·mol-1
-2878 kJ·mol-1
C.正丁烷转化为异丁烷的过程是一个放热过程
D.正丁烷比异丁烷稳定
17.做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→C O2↑+Mn2++□(未配平)。关于此反应的叙述正确的是
O2↑+Mn2++□(未配平)。关于此反应的叙述正确的是
A.该反应的氧化剂是H2C2O4
B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH-
D.配平该反应后,H+的计量数是6
16.下列用来表示物质变化的化学用语中,错误的是
A.钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-= 4OH-
B.向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+
C.1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1); H=-114.6kJ·mol-1
H=-114.6kJ·mol-1
D.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:
SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O
15.在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
14.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。
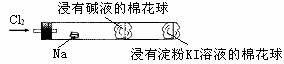
实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是
A.钠着火燃 烧产生苍白色火焰
烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.管右端棉球外颜色变化 可判断氯
可判断氯 气是否被碱液完全吸收
气是否被碱液完全吸收
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com