
34.(12分)下图为用含32P的T2噬菌体侵染大肠杆菌(T2噬菌体专性寄生在大肠杆菌细胞内)的实验,据图回答下列问题:
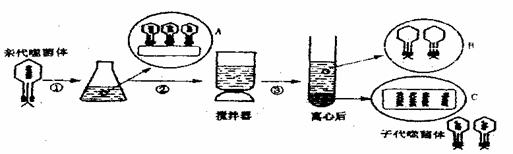
(1)根据上述实验对下列问题进行分析:图中锥形瓶的培养液是用来培养 ,其内的营养成分中是否含有32P ?
(2)对下列可能出现的实验误差进行分析:
①测定发现在搅拌离心后的上清液中含有0.8%的放射性,最可能的原因是
②当接种噬菌体后培养的时间过长,发现在搅拌离心后的上清液中也有较强放射性,其最可能的原因是 。
(3)请你设计一个给T2噬菌体标记上32P的实验:
①
②
③
33.(7分)人体维持内环境的相对稳定,对细胞正常生命活动非常重要。请回答下列问题。
(1)人体内环境通过 调节和 调节实现相对稳定。
(2)人体内环境主要包括 。
(3)体温相对恒定是保证内环境稳定的一个重要前提。体温调节中枢位于 ,温度感受器位于 上。与体温调节直接相关的两种激素是 和 。
32.(8分)请回答下列有关遗传信息传递的问题。
(1)为研究某病毒的致病过程,在实验室中做了如下图所示的模拟实验。
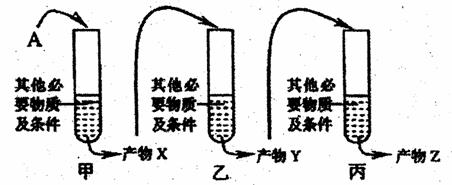
①从病毒中分离得到物质A。已知A是单链的生物大分子,其部分碱基序列为-GAACAUGUU-。将物质A加入试管甲中,反应后得到产物X。经测定产物X的部分碱基序列是-CTTGTACAA-,则试管甲中模拟的是 过程。
②将提纯的产物X加入试管乙,反应后得到产物Y。产物Y是能与核糖体结合的单链大分子,则产物Y是 ,试管乙中模拟的是 过程。
③将提纯的产物Y加入试管丙中,反应后得到产物Z。产物Z是组成该病毒外壳的化合物,则产物Z是 。
(2)若该病毒感染了小鼠上皮细胞,则组成子代病毒外壳的化合物的原料来自 ,而决定该化合物合成的遗传信息来自 。该病毒表面的衣壳的作用是
。
30.(15分)2009年12月7日至18日在哥本哈根召开的世界气候大会,六十多个国家的领导人出席了会议,体现了气候变化越来越引起人们的重视。在这次会议中,如何降低大气中CO2的含量及有效地开发利用CO2,成为了其中一个重要的议题。
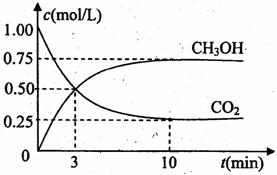
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②某一时刻,测得反应放出的热量为24.5kJ,则此时CO2的转化率为 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2
(2)在载入航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O
则阴极反应式为: 。
(3)如果反应必在一个体积可变的密闭容器中进行,其余条件不变,则达到平衡时CO2转化率与(1)中相比 (填“增大”、“减小”、“不变”或“无法确定”)
 31.(15分)谷氨酸是生物体内的一种重要的有机
31.(15分)谷氨酸是生物体内的一种重要的有机
小分子,谷氨酸钠是它的钠盐,是味精等调
味品的主要成分,目前利用微生物发酵生产的
氨基酸中,谷氨酸是产量最大的种类之一。
(1)谷氨酸R基为-CH2-CH2-COOH,
则谷氨酸的分子式为 。
(2)谷氨酸发酵的培养基成分,主要有葡萄糖、
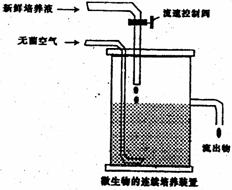
氨水、磷酸盐、生物素等,发酵装置如右
上图所示,可以判断谷氨酸棒状杆菌的新
陈代谢类型是 型。某厂用氨酸棒状杆菌生产谷氨酸,结果代谢产物中出现了大量乳酸,其原因可能是
。
(3)谷氨酸发酵生产过程中,需要添加氨水,试分析添加氨水的作用可能是什么?
① ②
(4)某厂的发酵液曾不慎被噬菌体污染,菌体大量死亡,但人们却侥幸从中获得了不少可抵抗噬菌体的新菌钟,细菌这种新性状的产生来自于 。要使优良菌种用于大规模生产,须选用 期的菌种进行扩大培养。
(5)当谷氨酸的合成过量时,就会抑制 的活性;从而导致合成途径中断,当谷氨酸因消耗而浓度下降时,抑制作用就被解除,该合成反应又重新开始,这种调节方式叫 。为了解除这种调节对生产的影响,在生产中采用的手段是 。
(6)连续培养时,以一定的速度不断添加新的培养基,同时以相同的速度放出旧的培养基,此工艺流程可以大大提高生产效率,其原因是:
①
②
28.(19分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为固体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
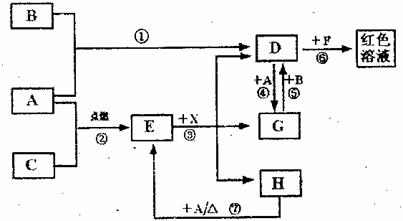
(1)写出下列物质的化学式:D ;X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应④的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;
该反应中每消耗0.3mol的A,可转移电子 mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式 。
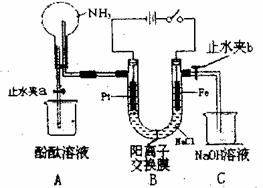 29.(16分)某课外活动小组设计了如图所示的装置,用于进行缓慢电解NaCl溶液及相关实验(此时找开止水夹a,关闭止水夹b)。由于某些原因,实验开始并没有达到预期的目的,但也看到了令人高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮他们分析原因,然后回答问题:
29.(16分)某课外活动小组设计了如图所示的装置,用于进行缓慢电解NaCl溶液及相关实验(此时找开止水夹a,关闭止水夹b)。由于某些原因,实验开始并没有达到预期的目的,但也看到了令人高兴的现象(阳离子交换膜只允许阳离子和水的通过)。请帮他们分析原因,然后回答问题:
(1)写出B装置中的电极反应:
阴极:
阳极:
(2)一段时间内依次观察到A中的现象为:
①
②
③
(3)当观察完A中的现象后,打开水止
夹b。再观察C装置,有无明显现象 (填“有”或“没有”),若无明显现象说明理由,若有现象请写出有关反应的化学方程式
(4)若想达到电解NaCl溶液的目的,请对该装置进行最简单的改进 ;并写出电解饱和NaCl溶液的离子方程式: 。
27.(10分)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 。
在高锰酸钾酸性溶液和草酸(H2C2O4,弱酸)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)请写出横线上所填物质的电子式: ,该反应中氧化剂是(填名称) ,写出草酸与足量NaOH溶液反应的离子方程式: 。
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
(3)若用已知浓度的酸性KMnO4溶液滴定未知浓度的H2C2O4溶液,则KMnO4溶液应装在 (填仪器名称)中。
26.(20分)直径轻弹簧的下端与水平地面上质量为M=0.20kg的甲木块连接,轻弹簧上端静止于A点(如图1),再将质量也为M=0.20kg乙木块与弹簧的上端连接,当甲、乙及弹簧均处于静止状态时,弹簧上端位于B点(如图2)。现向下用力压乙,当弹簧上端下降到C点时将弹簧锁定,C、A两点间的距离为△l=6.0cm。一个质量为m=0.10kg的小球丙从距离乙正上方h=0.45m处自由落下(如图3),当丙下落到位置C时,立即解除与弹簧的锁定。此后,丙与乙发生弹性碰撞(碰撞时间极短),问:
(1)碰撞后,乙、丙两物体的速度为多少?
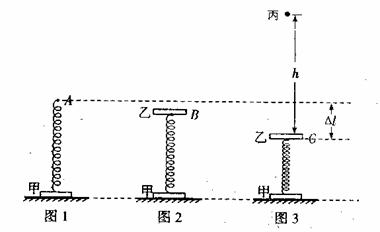 (2)若碰撞后取走小球丙,且已知当甲第一次刚离开地面时乙的速度为v = 2.0m/s。求从弹簧被解除锁定到至甲第一次刚离开地面时,弹簧弹性势能的改变量为多少?(g=10m/s2)
(2)若碰撞后取走小球丙,且已知当甲第一次刚离开地面时乙的速度为v = 2.0m/s。求从弹簧被解除锁定到至甲第一次刚离开地面时,弹簧弹性势能的改变量为多少?(g=10m/s2)
25.(18分)如图所示,某货场要将质量为m1=100kg的货物(可视为质点)从高处运送到地面,为避免货物与地面发生撞击,现利用固定于地面的光滑四分之一圆轨道,使货物由轨道顶端无初速滑下,轨道半径R=1.8 m。地面上紧靠轨道依次排放两块完全相同的木板A、B,长度均为l=2m,质量均为m2=100 kg,木板上表面与轨道末端相切。货物与木板间的动摩擦因数为 1,木板与地面间的动摩擦因数
1,木板与地面间的动摩擦因数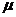 =0.2。(最大静摩擦力与滑动摩擦力大小相等,取g=10 m/s2)
=0.2。(最大静摩擦力与滑动摩擦力大小相等,取g=10 m/s2)
(1)求货物到达圆轨道末端时对轨道的压力。
(2)若货物滑上木板A时,木板不动,而滑上木板B时,木板B开始滑动,求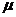 1应满足的条件。
1应满足的条件。
(3)若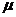 1=0.5,求货物滑到木板A末端时的速度和在木板A上运动的时间。
1=0.5,求货物滑到木板A末端时的速度和在木板A上运动的时间。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com