
1. 下列描述的元素中,一定属于主族元素的有 ( )
A.元素的原子最外层电子个数为2
B.元素的原子最外层电子个数为6
C.位于元素周期表中ⅡA族右边的元素
D.阴离子RO4-中R元素
(本题考查原子结构与元素周期表结构的关系,答题时注意特例的分析)
3. (2002年上海高考题)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O、HF;
第三周期 SiH4>PH3> > 。
(2)化合物的毒性:PH3>NH3 H2S H2O;
CS2 CO2 CCl4 CF4 (选填>或<或=)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是 。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。但求助于周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
a.①②③ b.②④⑤ c.②③④
(本题考查元素周期表中元素化合物性质的变化规律,归纳总结规律是解答本题的关键)
新活题网站
2.(2001年全国高考题)下列化合物中阴离子半径和阳离子半径之比最大的是
( )
A.LiI B.NaBr C.KCl D.CsF
(本题主要考查离子半径大小比较,答题时注意运用元素周期表定位分析)
1.(2001年全国高考题)下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
(本题综合考查原子结构、同位素、元素周期表的结构等,答题时要逐项审视,选出错误的说法)
4. 粒子半径大小比较的规律
⑴同一主族各元素,原子半径大小看电子层数;
⑵同一周期各元素,原子半径随原子序数递增而递减,阴离子半径一定大于阳离子半径;
⑶核外电子排布相同的离子,原子序数愈小,离子半径愈大;
⑷阴离子半径大于相应原子半径,阳离子半径小于相应原子半径。
典型题点击
3. 原子结构与元素周期表关系的规律
⑴电子层数=周期数(电子层数决定周期数)
⑵最外层电子数=主族数=最高正价数=价电子数
⑶负价绝对值=8-主族数(限ⅣA--ⅦA)
⑷原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物的对应水化物的碱性越强,其离子的氧化性越弱;原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物的对应水化物的酸性越强,其离子的还原性越弱。
2. 元素金属性或非金属性强弱的实验标志
⑴金属性强弱:①单质与水或酸反应置换出H2的难易;②元素最高价氧化物对应水化物的碱性强弱;③单质的还原性强弱或离子的氧化性强弱;④原电池反应中的正负极。
⑵非金属性强弱:①单质与H2化合生成气态氢化物难易;②生成气态氢化物的稳定性;③ 元素最高价氧化物对应水化物的酸性强弱;④单质的氧化性强弱或简单离子的还原
性强弱。
1. 元素周期律
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫元素周期律。元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果,这就是元素周期律的实质。
34.读地球公转示意图,假如E为近日点时,完成下列各题。(13分)
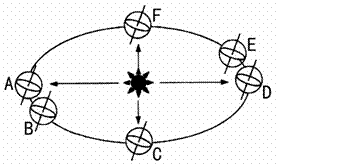
(1)在图九中地球公转轨道上画出公转的方向。(1分)
(2)广东省汕头市有一口井正好位于北回归线上,当阳光直射井底时,地球位于图中
__________点附近(填字母,下同)。(1分)
(3)图中__________点表示地球运行至远日点;地球从A点运行到C点的过程中,公转速度的变化规律是____________________________________________。(4分)
(4)当全球极昼、极夜范围达到最大时,地球应位于________、________点。(2分)
(5)当地球从C点运行到F点时,合肥昼夜长短的变化规律是____________________
____________________________________________________________。(3分)
(6)当地球处于D位置时,全球正午太阳高度角随纬度的变化规律是
(2分)
|
安徽省两地三校2009-2010学年高二元旦联考地理试卷
33. 读植被的减水和减沙效益表,回答下列问题。(共8分)
|
植被覆盖率(%) |
径流减少率(%) |
侵蚀减少率(%) |
|
20 |
15 |
55~20 |
|
40 |
30 |
80~40 |
|
60 |
60~30 |
95~70 |
|
80 |
75~50 |
98~80 |
|
≥90 |
70 |
100~90 |
(1)从表中的数据可知,当植被覆盖率提高时,径流量会 (增大或减少),
水土流失会 (严重或减轻)。(2分)
(2)在黄土高原植树造林有利于( )(2分)
A.阻挡风沙,保护农田 B.调节气候,美化环境
C.涵养水源,保持水土 D.吸烟滞尘,净化空气
(3)与生物措施配合,黄土高原还可采取哪些措施改善环境?(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com