
读下图,回答6-8题:
6. 若图是以赤道某点为中心的侧视图,M、N是赤道与圆的两个交点,其直线距离为R(R为地球半径)。图中各点的经线恰好为12月12日的范围,则北京时间可能为:( )
若图是以赤道某点为中心的侧视图,M、N是赤道与圆的两个交点,其直线距离为R(R为地球半径)。图中各点的经线恰好为12月12日的范围,则北京时间可能为:( )
A.12日8:00 B.12日16:00
C.11日0:00 D.13日16:00
7.若图为以极点为中心的俯视图,M、N所在经线两侧为不同日期,则我国大陆最东端所在时区的区时为:( )
A.7:00 B.8:00 C.9:00 D.10:00
8.若图为地球侧视图,MN为赤道,图示部分既是西半球又是昼半球,且北京正午人影越来越长,则此时北京时间为:( )
A.3月21日3:20 B.3月21日15:20
C.9月23日3:20 D.9月23日15:20
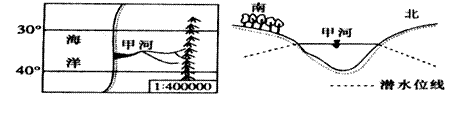 读下图,根据图中信息回答9题:
读下图,根据图中信息回答9题:
 读右图回答4-5题。
读右图回答4-5题。
4. 若此图是冬季风环流侧视图,影响我国的西北风的序号是
若此图是冬季风环流侧视图,影响我国的西北风的序号是
( )
A.① B.② C.③ D.④
5. 若此图为大气三圈环流中的中纬环流侧视图,则A处表示的气压带和③处表示的风带分别为 ( )
A.副热带高气压带 信风带 B.副极地低气压带 盛行西风带
C.极地高气压带 盛行西风带 D.副热带高气压带 盛行西风带
 如图所示,线a、b、c为等压线,箭头表示A地风向,线d、e为等温线,线f为等高线,完成1-3题。
如图所示,线a、b、c为等压线,箭头表示A地风向,线d、e为等温线,线f为等高线,完成1-3题。
1. 有关该地的描述正确的是( )
A.河流的流向大致是东南流向西北
B.湖泊水是该河流重要补给来源
C.该地最有可能是南半球某地
D.该湖泊为咸水湖
2. A地未来几日天气状况可能是( )
A.晴朗、气温高、气压低 B.晴朗、气温低、气压高
C.阴雨、气温降低、气压升高 D.阴雨、气温升高、气压降低
3 下列说法正确的是( )
A.a、b、c值的大小关系是a < b < c B.d、e等温线值的大小关系是d > e
C.该地可能出现土壤次生盐渍化 D.若e的值是0℃,则图中河流出现凌汛现象

|
|
选项 |
实 验 操 作 及 现 象 |
实 验
结 论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
|
D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com