
16、一种新型熔融盐燃料电池具有高发电效率而备受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2。则下列说法中正确的是
A. 通CO的一极是电池的正极
B. 正极发生氧化反应
C. 负极电极反应是:O2+2CO2+4e-=2CO32-
D. 熔融盐中CO32-的物质的量在工作时保持不变
15、几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
+1 |
下列叙述正确的是
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有共价键和离子键
14、固体A的化学式为NH5,它的所有原子的最外层都符合相应希有气体原子的最外电子层结构,则下列有关说法中不正确的是
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.1molNH5中含有5molN-H键
D.NH5固体投入少量水中,可产生两种气体
13、A、B、C、D、E是同周期的五种元素,A和B的最高氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物稳定性为C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由小到大的顺序是
A. BAEDC B. CDABE C. EBADC D. CDEAB
12、有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-离子中的几种。为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰。下列推断正确的是( )
A.肯定有Na+、Al3+、Mg2+、SO42- B.肯定有Na+、Mg2+、Al3+、HCO3-
C.肯定没有K+、HCO3-、MnO4- D.肯定没有K+、NH4+、Cl-
11、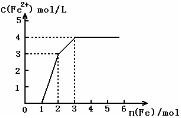 现有含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe 与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+ 浓度和加入铁粉物质的量之间关系如图所示则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
现有含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe 与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+ 浓度和加入铁粉物质的量之间关系如图所示则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1︰1︰1 B.1︰3︰1 C.1︰1︰4 D.3︰3︰8
10、下列物质变化时,需克服的作用力不属于化学键的是
A. HCl溶于水 B. I2升华 C. H2O电解 D. 烧碱熔化
9、下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
8、下列各组热化学方程式的⊿H前者大于后者的是
①C(s)+O2(g)==CO2(g);⊿H1;
C(s)+ O2(g) ==CO(g);⊿H2
O2(g) ==CO(g);⊿H2
②S(s)+ O2 (g)== SO2 (g);⊿H3; S(g)+ O2 (g)== SO2 (g);⊿H4
③H2(s) + O2(g) == H2O(g) ; ⊿H5;2H2(g) +O2(g)=2H2O(l)⊿H6
O2(g) == H2O(g) ; ⊿H5;2H2(g) +O2(g)=2H2O(l)⊿H6
④CaCO3(s) == CaO(s) + CO2(g) ;⊿H7 ; CaO(s)+H2O(l) == Ca(OH)2(s) ⊿H
A. ① B. ②④ C. ②③④ D. ①②③
7、已知氢气的燃烧热为285.8kJ/mol,CO的燃烧热为282.8kJ/mol。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列说法正确的是
A. CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g);ΔH=+282.8kJ/mol[来
B. H2燃烧的热化学方程式为:2H2+O2(g)=2H2O(g);ΔH=-571.6kJ/mol
C. 燃烧前混合气体中H2的体积分数为60%
D. 燃烧后的混合气体与足量的过氧化钠作用可产生1.25mol氧气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com