
9.(9分)(3)NH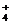 +NO
+NO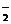
N2↑+2H2O(2分)
(5)反应后的气体中碳、氧原子的物质的量之比为2:3,二氧化碳分子中碳、氧原子个数之比为1:2,两者不相符,故原假设不成立。(2分)
|
(6)CO和CO2(2分) 2C+Fe2O3 2Fe+CO↑+CO2↑
(7)在尾气出口处加一点燃的酒精灯或增加一尾气处理装置(1分)
8. 实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)实验Ⅱ:氢氧化铁胶体(或胶体);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生(3分);Fe3++3SCN-=Fe(SCN)3;Ba2++SO42-=BaSO4↓。实验III:Fe3+与SO32-同时发生氧化还原反应和双水解反应
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
①SO32-有较强的还原性,CO32-没有还原性(2分);②SO32-水解能力较CO32-小
7. (1)①⑨⑩⑥⑤③④⑧⑦②
(2)吸收SO3放出等物质的量的SO2
(3)干燥SO2和O2
(4)短进长出
(5)O2(1分)3CuSO4 3CuO+2SO2↑+SO3↑+O2↑
3CuO+2SO2↑+SO3↑+O2↑
(6)B、E
6. (1)甲: ①中用分液漏斗可以控制液体的流量,控制反应的进行;
②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;
②中的斜、长导管起到冷凝回流乙醇蒸汽的作用
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证
丙;①中氧气发生装置中无水生成,且装置简单
(2)丙①;甲②;乙③
(3)温度计;控制水浴温度在78 ℃或略高于78 ℃,使乙醇蒸汽平稳流出,减少挥发,提高反应效率
(4)c处无水硫酸铜变蓝;d处生成红色沉淀
(5)

5.[答案](l) 3Fe+4H2O(g)  Fe3O4+4H2↑
Fe3O4+4H2↑
(2)检验足否有H2产生

(4)取少量溶液于试管中,滴入几滴KSCN溶液,"观察溶液颜色。如果颜色变红,说明溶液中含有Fe3+,否则不含Fe3+·
(5)如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色。反应的离子方程式为Fe+2Fe3+=3Fe2+,
(6)①4Fe(OH)2+O2+2H2O==4Fe(OH)3
②第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2-3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量。
4.答案:(1)4HNO3(浓)  4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
(2)不正确(1分),带火星的木条熄灭可能是由于加热水蒸气时产生大量水蒸气。
II.(1)2Cu(NO3)2  2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
(2)正确,硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃
III.用金属铜与浓硝酸反应制取NO2气体,并用浓硫酸或无水氯化钙进行干燥,再将带火星的木条伸入二氧化氮中观察现象
3、答案:
(1)A接GFI,B接DEC
(2)正
(3)淀粉碘化钾溶液变蓝色
(4)12
2.答案:⑴NO NO2 N2 H2 ⑵酸性 氧化性
⑶Fe2O3+3H2 2Fe+3H2O N2+3H2 2NH3
⑷12Mg+30H++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2O
1.[答案](12分)
(1)否 硫酸溶质质量分数为23%<60%,其氧化性不突出所以无明显现象(2分)
(2)铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色。(2分)
(3)现象是: 液体无色或浅蓝色,有白色固体在试管底部析出。(2分)
原因:98%浓H2SO4有吸水性只剩无水硫酸铜。(2分)
待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌。(2分)
(4)Cu2S或硫化铜或Cu2S与硫化铜的混合物(2分)
11.某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。
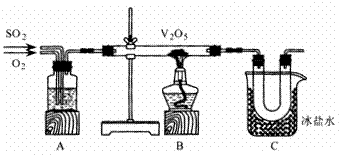
试回答下列问题:
(1)已知6.4 g二氧化硫被氧气氧化成气态三氧化硫,放出9.83 kJ热量。该反应的热化学方程式为____________________。
(2)A装置可用来观察二氧化硫和氧气的进气量,试剂瓶内的药品是浓硫酸。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相等,其目的是______________。
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是____________________;在实验过程中此操作不能持续进行的理由是__________________。
(4)若用a g铜跟足量浓硫酸反应制二氧化硫,实验结束时得到b g三氧化硫,该实验中二氧化硫的转化率不小于________。
(5)老师说该实验装置设计不完整,请你协助该研究小组设计出所缺装置并在右边方框中画出。

实验答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com