
23、B (6分)化合物SOCl2是一种液态化合物,沸点为77℃。在盛有10 mL水的锥形瓶中,小心地滴加8-10滴SOCL2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:______________________________
(2)AlCl3溶液蒸干灼烧得不到无水AlCL3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是______________________________________________________
22、B (6分)有3种可溶性离子化合物A、B、C,它们分别由阳离子NH4+、Na+、Cu2+和阴离子OH-、S2-、SO42-两两结合而成,取质量相等的A、B、C分别溶解于水,配成等体积的溶液,这3种溶液物质的量浓度大小的顺序是B>A>C,根据题意回答下列问题:
(1)推断出A是__________,B是__________,C是_______________
(2)室温时C溶液的pH____________7。(填“>、=、<”)
(3)写出A与B溶液混合发生反应的离子方程式:___________________________________
(4)写出B与C溶液混合发生反应的离子方程式:____________________________________
21、B (8分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=11的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL,
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质
(1)在两个方案的第①步中,都要用到的定量仪器是_______________________________
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH_______1。(选填“>、=、<”)
乙方案中,说明HA是弱电解质的现象是___________。(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快
(b)装HA溶液的试管中放出H2的速率快
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处是:______________________________
(4)请你评价:乙方案中难以实现之处和不妥之处是:______________________________
19
B (6分)某二元弱酸(简写为H2A)溶液,按下式发生一级电离和二级电离:H2A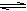 H+ + HA-,HA-
H+ + HA-,HA-
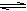 H+
+ A2-。已知相同浓度时的电离程度
H+
+ A2-。已知相同浓度时的电离程度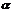 (H2A)>
(H2A)>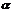 (HA-),设有下列四种溶液:
(HA-),设有下列四种溶液:
A.0.01 mol/L的H2A溶液 B.0.01 mol/L的NaHA溶液
C.0.02 mol/L的HCl与0.04 mol/L的NaHA溶液等体积混合液
D.0.02 mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)c(H+)最大的是__________,最小的是____________。
(2)c(H2A)最大的是__________,最小的是____________。
(3)c(A2-)最大的是___________,最小的是______________。
20、B (5分)某学生用0.1 mol/L的KOH标准溶液未知浓度盐酸,其操作分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式海阔天空至0刻度以上2-3 cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空
(1)正确操作步骤的顺序是(用序号字母填写)___________________________________
(2)上述B步骤操作的目的是_________________________________________________
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是____________
(4)判断到达滴定终点的实验现象是_____________________________________
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是____________________________________
18、B 在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的pH变大
B.盐酸和醋酸都可用相应的钠盐与浓度硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ(非选择题 共54分)
17、B 足量镁粉与一定量的盐酸反应,能产生一定量的氢气。由于反应太快,不易操作。为减慢反应速率,但不影响氢气的总量,可以加入下列物质中的
A.H2O B.NaOH C.Na2CO3 D.CH3COONa
16、B 在某温度时,测得纯水中的c(H+)=2.4×10-7 mol/L,则c(OH-)为
A.2.4×10-7 mol/L B.0.1×10-7 mol/L
C.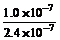 mol/L D.c(OH-)无法确定
mol/L D.c(OH-)无法确定
15、B 等物质的量浓度的下列溶液中,NH4+离子的浓度最小的是
A.(NH4)2CO3 B.NH4HCO3 C.NH4HSO4 D.NH4NO3
14、B 下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
13、B 某溶液中FeCl3的水解反应已达到平衡:FeCl3
+ 3H2O 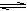 Fe(OH)3
+ 3HCl,若要使FeCl3的水解程度 增大,应采用的方法是
Fe(OH)3
+ 3HCl,若要使FeCl3的水解程度 增大,应采用的方法是
A.加入NaHCO3 B.加入AgNO3 C.加FeCl3固体 D.加热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com