
10.元素周期表中结构与位置的四个关系:①
② ③
④
画出元素周期表
9.元素周期表中有 个纵行,分为 个族,其中 个主族 个副族,还有 族和
族。
8.元素周期表分 个周期,第1、2、3周期为 周期,元素种类依次为 ;第4、5、6周期为 周期,元素种类依次为 ;第7周期为 周期,目前有种 元素,如果全部排满是 种元素。
7.从原子结构的观点看,元素周期表中同一横行的短周期元素,其 相同, 不同;同一纵行的主族元素,其 相同, 不同。
6.元素周期律: 。
元素性质的周期性变化是 必然结果。
注:元素主要化合价与原子结构的关系规律:
a.主族元素最高正价等于 。b.元素的负化合价等于 。
c.元素的最高正价和负化合价绝对值之和等于 。由此还可推知最高正价氧化物和气态氢化物及最高价氧化物相应水化物通式。
5.写出下列元素的原子或离子的结构示意图:氢离子 硫
氮 氯离子 磷 碳 钠离子 。
4.核外电子的排布的四个规律:
①核外电子分层排布,由里向外,先排满K层再排L层;
②各电子层最多容纳的电子数目 ,即K层为 个,L层 个;
③最外层电子数目不超过 (K层为最外层不超过 个);
④次外层电子数不超过 个,倒数第三层电子数目不超过 个。
如:砹(At)为85号元素,其原子结构示意图为 。
 注:a.
能量最低原理,就是核外电子总是尽先排布在能量 低的电子层里,然后再由
往
依次排布在能量逐步
高的电子层里。
注:a.
能量最低原理,就是核外电子总是尽先排布在能量 低的电子层里,然后再由
往
依次排布在能量逐步
高的电子层里。
b.十电子体:①分子: ② 阴离子:
③阳离子:
c. 十八电子体:①分子:
②阴离子:
③阳离子:
3.三个概念:①元素:
②核素:
③同位素:
如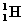 ,
,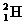 ,
,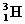 、
、
等。
、
、
等。
注:a. 同位素的性质:同一元素的同位素化学性质 ;在天然存在的某种元素中,不论游离态还是化合态,同位素原子的百分比 。
b.几种重要的核素:用以制造氢弹的是: ;原子弹的核燃料为 ;应用于考古的是
2.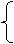 两个关系:①电量关系:核电荷数=
数=
数。(对于原子)
两个关系:①电量关系:核电荷数=
数=
数。(对于原子)
②质量关系:
 注:①对于离子,上述质量关系成立,但电量关系不再成立
注:①对于离子,上述质量关系成立,但电量关系不再成立
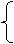 阳离子:原子
形成,因此核外电子数
质子数
核电荷数
阳离子:原子
形成,因此核外电子数
质子数
核电荷数
阴离子:原子 形成,因此核外电子数 质子数 核电荷数
②说明:如果忽略电子的质量,将原子核内所有的 和 的相对质量取近似整数值加起来,所得数值,叫做质量数关系:
质量数(
)=
+
如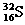 则16表示
,32表示 ,中子数为
。
则16表示
,32表示 ,中子数为
。
③原子的表示方法:
*注:几种相对原子质量比较
①原子的相对原子质量:
②原子的近似相对原子质量:
③元素的相对原子质量:
④元素的近似相对原子质量:
1. 一种结构:
一种结构:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com