
26.(12分)龙海实验学校初三兴趣小组利用如下装置(部分固定装置已略去)制备氮化钙,并探究其化学式(实验式)。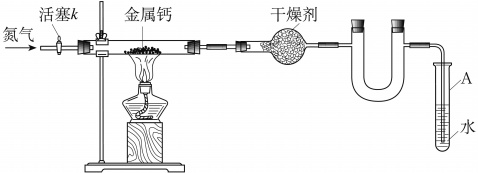
(1)按图连接好实验装置。检查装置气密性的方法是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
|
空硬玻璃管质量m0/g |
硬玻璃管与钙的质量m1/g |
硬玻璃管与产物的质量m2/g |
|
114.8 |
120.8 |
122.2 |
①计算得到化学式(实验式)CaxN2,其中x= 。
②若通入的N2中混有少量O2,如上计算得到的x 3(填写“>”、“=”、“<”),判断依据是: 。
25.(4分)你认为下列有关化学实验的叙述是否正确?(在“结论”栏中填“是”或“否”)
|
序号 |
实验现象或数据 |
结论 |
|
1 |
分别加热溶质的质量分数为1%的Na2CO3和NaHCO3溶液,观察气泡的生成可区分出这两种溶液 |
|
|
2 |
用pH试纸测定一杯敞口久置于空气中的蒸馏水的pH为6 |
|
|
3 |
配制溶质的质量分数为1%的澄清石灰水备用 |
|
|
4 |
用排水法收满3瓶(每瓶250 mL)O2[ρ(O2)=1.43 g/L],需称取的氯酸钾的质量为2.74 g |
|
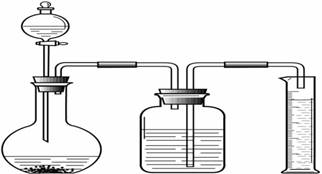
24.(4分)某兴趣小组用右图所示装置收集并测量反应产生的气体及其体积。若用该装置制取氢气,通过分液漏斗中加入30 mL稀盐酸,与平底烧瓶中盛放的0.65 g锌粒充分反应(盐酸足量),已知该温度下氢气的密度为0.0892 g /
L,应能收集到 mL的氢气?3次实验收集到的氢气体积的平均值约为242 mL。你认为造成这种实验误差的主要原因是
。
23.(6分)两种抗胃酸药剂的主要成分及建议每次剂量见下表:
|
主要成分 |
NaHCO3 |
Mg(OH)2 |
|
主要成分相对分子质量 |
84 |
58 |
|
建议每次剂量/g |
0.5 |
0.3 |
(1)医生建议胃溃疡患者尽可能不要服用NaHCO3的可能原因是:
。
(2)服用Mg(OH)2的药效比服用NaHCO3“强”而且“持久”的可能原因是:
。
(3)服用Mg(OH)2的患者可能出现“轻泻”的原因是:
。
22.(4分)金属镁可与热水反应生成氢氧化镁,所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
(1)溶液的红色褪去说明溶液的碱性 ;
(2)据你推测,导致溶液碱性变化的原因是:
。
(3)设计一个实验来验证你的一种推测,简要说明操作、现象及结论。
20.(6分)某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,用盐酸酸化,有白色沉淀生成(不溶于稀硝酸)。过滤,将所得的滤液分成两份,一份滤液中加入稀硫酸,也有白色沉淀生成(不溶于稀硝酸);另一份滤液中加入足量NaOH溶液,产生蓝色沉淀。已知白色的Fe(OH)2固体在潮湿的空气中可生成红褐色的Fe(OH)3。试回答:
(1)过滤后,向滤液中滴加NaOH溶液,开始时观察不到蓝色沉淀,原因是:
。
(2)该同学设计了一个从废水中除去重金属离子的实验方案如下: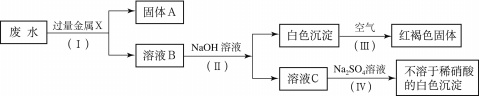
①固体A中一定含有的物质为 (写化学式)。
②B溶液中的溶质一定含有 (写化学式)。
19.(5分)有核电荷数小于18的A、B、C、D四种元素,A元素组成的单质是清洁的能源;B单质的体积在空气中占21%;C原子有3个电子层,最内层电子数是最外层的2倍;D元素是农作物生长所需要的营养元素,其组成的单质可以被豆科植物的根瘤菌吸收、利用。
(1)写出B、D元素的名称:B , D 。
(2)写出A、B可能形成化合物的化学式 、 。
(3)写出由A、B、D三种元素组成的两种化合物之间发生中和反应的化学方程式 。
(4)活泼性强的金属氢化物的化学式可表示为MHn,它与水剧烈反应生成碱和A的单质,请写出C的氢化物与水发生反应的化学方程式 。
18.(7分)现测得二氧化碳在空气中的含量为0.038%,当其含量超过0.05%时就会加剧温室效应。所以人们一方面想限制其排放量,另一方面又想对它进行再利用。
(1)目前有以超临界(一种介于气态和液态之间的状态)CO2作致冷剂(以前曾用氟利昂),这种做法对环境的积极意义在于 。
(2)有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH)。该技术流程如下:
(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂。)
① 合成塔中反应的化学方程式为 。
② 请在上述流程图中找出循环利用的物质(标出物质名称和循环方向)。
③ 如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?并简述理由
。
④ 若生产4.8吨甲醇,则可回收空气中的CO2 吨。
17.(3分)汽车安装的排气净化器的技术核心是使用高效催化剂,使废气中的CO和NOx在催化剂表面进行氧化还原反应。
(1)写出氮氧化物(用NOx表示)跟CO反应转化为无毒物质的化学方程式 。
(2)若汽车尾气中含有38 g NO和NO2的混合物,经过充分转化后生成无毒物质的质量(m)范围是 (计算结果保留1位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com