
9、常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,判断:
① 溶液中共有________种微粒(包括分子和离子);
② 溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是______和_______;
③ 溶液中n(CH3COO_)+ n(OH_) -n(H+)=_____________mol。
8、某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
 H2A H++HA-, HA- H++A2-,已知相同浓度时的电高度a(H2A)>d(HA-),设有下列四种溶液:
A. 0.01mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.O2 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)[H+]最大的是______________________,最小的是___________________.
(2)[H2A]最大的是______________________,最小的是___________________.
(3)[A2-]最大的是______________________,最小的是___________________.
H2A H++HA-, HA- H++A2-,已知相同浓度时的电高度a(H2A)>d(HA-),设有下列四种溶液:
A. 0.01mol/L的H2A溶液
B.0.01mol/L的NaHA溶液
C.0.01mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0.02mol/L的NaOH与0.O2 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)[H+]最大的是______________________,最小的是___________________.
(2)[H2A]最大的是______________________,最小的是___________________.
(3)[A2-]最大的是______________________,最小的是___________________.
7、用下列方法测定空气的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体电阻越小,它电导越大)。如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大,若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度。现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的:( )
A Na2SO3 B KI溶液 C NaOH溶液 D H2O
6、若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为 A、10(a+b-12)% B、10(a+b-14)% C、10(12-a-b)% D、10(14-a-b)%
5、常温下,强酸溶液A和强碱溶液B的pH之和为16,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是:( )
 A 1︰10 B 10︰1 C 1︰100
D 100︰1
A 1︰10 B 10︰1 C 1︰100
D 100︰1
4、室温时,若0.1mol/L的一元弱碱的电离度为1%,则下列说法正确的是( ) A该溶液的pH=11 B该溶液的pH=3 C加入等体积0.1mol·L-1HCL后所得溶液的pH=7 D加入等体积0.1mol·L-1HCl后所得溶液的pH>7
3、已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2。对于该溶液下列叙述中不正确的是:( )
A 该温度高于25℃ B 水电离出来的c(H+)=1×10-10mol/L
C c(H+)=c(OH-)+c(SO42-) D 该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
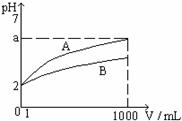
2、pH = 2的A、B两种酸溶液各1mL, 分别加水稀释到1000mL, 其溶液的pH与溶液体积(V)的关系如右图所示, 则下列说法正确的是
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a = 5时, A是强酸, B是弱酸
D.若A、B都是弱酸, 则5 > a > 2
1、在0.01mol/L的醋酸中加入少量硫酸后,其变化结果是:( )
A 酸性增强,pH减小 B 醋酸的浓度减小
C 氢离子浓度变小 D 醋酸根离子浓度变小
8、pH=3的盐酸和pH=3的醋酸溶液,由水电离产生的c(H+):( )
A 前者大于后者 B 前者小于后者 C 前者等于后者 D 不能确定
课外作业
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com