
2.溶液的PH值:
(1)概念: 。
(2)表达式:
PH值适合于表示 溶液的酸碱性,为什么?
1.溶液的酸碱性:25°C时:中性溶液c(H+)=c(OH-)=
PH= ;酸性溶液 ;
碱性溶液 ;溶液的酸碱性
与溶液PH值是否等于7 (填有关或无关),与溶液中c(H+)和
c(OH-)的 有关。
3.水的离子积:在一定温度下,水中或 中c(H+)与c(OH-)
的乘积是一个常数,用Kw表示,称为水的离子积常数,温度不同,Kw不同,
在25°C时,Kw= = ;当温度升高时,Kw将 ,比如
在100°C时,Kw= ,此时水的电离度为 。
在常温下,c(H+)=0.01mol/L的强酸溶液与c(OH-)=0.01mol/L的强碱溶液
中,Kw= ,水的电离度= 。
2.影响水的电离平衡的因素:(1)温度:当温度升高时,水的电离平衡
向 方向移动,这时水中的c(H+)、c(OH-)如何变化?水的电离度 。
(2)浓度:往水中加入酸或碱,水的电离平衡的移动方向是 ,
水的电离度将 ;若往水中加入强碱弱酸盐或强酸弱碱盐,水的电
离平衡的移动方向是 ,水的电离度将 ;
1.水的电离和电离平衡:水是一种 电解质,它能微弱地电离,
生成 和 离子,电离方程式为 ,
简写为: ;ΔH<0。在一定温度下,纯水电离生成的
c(H+)=c(OH-),实验测得在25°C时,c(H+)=c(OH-)= 。
此时水的电离度为 。
4.通过水的离子积和溶液酸碱性等内容的教学,对学生进行矛盾的对立统一、事物间的相互关系和相互制约等辨证唯物主义观点的教育。


教与学方案 笔记与反思
[自学反馈]
3.掌握酸碱的pH值计算以及氢离子浓度和pH值的互算。
2.了解指示剂的变色范围,学会用pH试纸测定溶液的pH值。
1. 从水的电离平衡去理解水的离子积和溶液pH值的含义,掌握溶液pH值跟氢离子浓度和溶液酸碱性的关系。
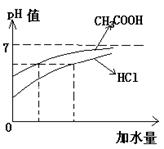
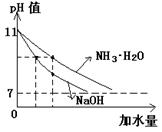
10、现有下列两组溶液(Ⅰ)组:0.1mol/L的醋酸和盐酸,(Ⅱ)组:pH值=11
的氨水和氢氧化钠溶液。若将它们加水稀释相同的倍数,试比较(Ⅰ)组和(Ⅱ)组
溶液pH值的大小:(Ⅰ)组________,(Ⅱ)组___________。
第三章 水溶液中的离子平衡
第二课时 水的电离和溶液的酸碱性
班别_______________姓名__________________学号_________
编写:冯尚敬 审核:徐玲
[考纲要求]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com