
(一)无机的:爆鸣气(H2与O2); 水煤气或煤气(CO与H2);碳酸气(CO2)
(二)混合物:氨水(分子:NH3、H2O、NH3·H2O;离子:NH4+、OH‾、H+)
氯水(分子:Cl2、H2O、HClO;离子:H+、Cl‾、ClO‾、OH‾)
苏打水(Na2CO3的溶液) 生理盐水(0.9%的NaCl溶液)
水玻璃(Na2SiO3水溶液) 卤水(MgCl2、NaCl及少量MgSO4)
水泥(2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3) 王水(由浓HNO3和浓盐酸以1∶3的体积比配制成的混合物)
2、各种“气”汇集
(一)纯净物:重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg; 水晶SiO2。
1.物质的组成和分类
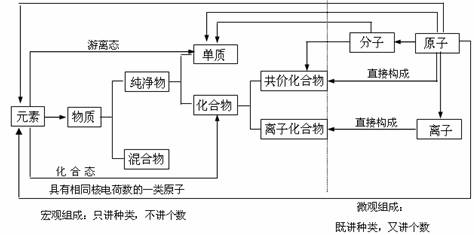
注:(1)组成物质的几种微粒的概念
①分子:分子是保持物质化学性质的一种微粒。分子是由原子组成的,不显电性。
②原子:原子是化学变化中的最小微粒。原子由原子核和核外电子构成,呈电中性。
③离子:离子是带电的原子或原子团。根据离子电荷电性的差异,离子可分为阳郭子和阴离子。带正电荷的是阳离子,带负电荷的是阴离子。[Fe(SCN)]2+是带正电荷的原子团。NO3-、SO42-是带负电荷原子团。
④原子团:两个或多个原子结合在一起,在许多化学反就中作为一个整体参加,好象一个原子一样,这样的原子的集团叫做原子团。如OH- 、NO3-、SO42-
(2)无机化合物分类
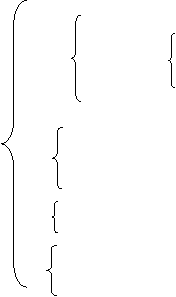 氢化物:如HCl、H2O、NH3、NaH 等
氢化物:如HCl、H2O、NH3、NaH 等
不成盐氧化物:如NO、CO、NO2等
氧化物:酸性氧化物:如CO2、SO3、P2O5等
成盐氧化物: 碱性氧化物:如Na2O、K2O、BaO等
两性氧化物:如Al2O3等
过氧化物 :如Na2O2、H2O2等
按电离出的H+个数(一元酸、二元酸、三元酸等)
无机化合物 按酸根是否含氧(无氧酸和含氧酸)
酸 按有无挥发性(挥发性酸和不挥发性酸)
按酸性强弱(强酸和弱酸)
按水溶性(可溶性和难溶性)
碱 按碱性强弱(强碱和弱碱)
正盐:如BaSO4、KNO3、NH4Cl等
盐 酸式盐:如NaHCO3、NaHSO4、NaHS等
碱式盐:如Cu2(OH)2CO3等
复盐:如KAl(SO4)2 ·12H2O等
2.物质的性质和变化

|

|
|


 子
子
表现
 没有新物质
没有新物质
 生成
生成
决定 决定
化学变化 有新物质
中表现出来 生成
表现出 表现
在物质的组成、分类、性质和变化这一知识块中,包含着大量的基本概念,是化学概念的主要集中营,也是高考命制概念型试题的“原料库”,复习中应充分了解概念的形成、内涵、适用条件、应用范围和不同概念之间的联系,运用抓“关键词”法、比较法、联系法等方法学好基本概念。
例如,学习中可以进行对“同类”概念抓“异”(不同点)的挖掘,对“对立”概念抓“同”(相同点)的开发。所谓“同类”概念,即概念之间有某些相同的含义,如“同位素、同素异形体、同分异构体、同系物、同类物、同一物质”;“溶解平衡、化学平衡、水解平衡、电离平衡”;“加热、微热、高温、锻烧、灼烧、自燃”;“酸性的强弱、酸的强弱、酸的浓度、pH,酸的氧化性和氧化性酸”;“蒸馏、分馏”;“电离、电解、电镀、电泳、通电”;“水化、水解、水合”等等,对这些“同类”概念,可列表比较,分析异同,以便于理解记忆。所谓“对立”概念,即概念之间有彼此相反而截然对立的概念,如“化合与分解”、“氧化与还原”、“中和与水解”、“溶解与结晶”、“加成与消去”、“电解池与原电池”、“电解质与非电解质”等,将它们联系对比,也是一种行之有效、深化并掌握概念的重要方法。
注:1、各种“水”汇集
28.(11分)(2007山东卷) 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:

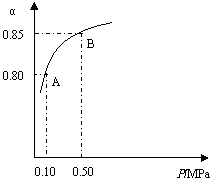 2SO2(g)+O2(g) 2SO3(g)
2SO2(g)+O2(g) 2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强
(P)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
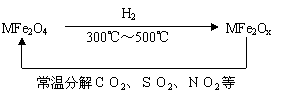
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
27.(06年上海卷)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______________,K值大小与温度的关系是:温度升高,K值______________。(填一定增大、一定减小、或可能增大也可能减小)。
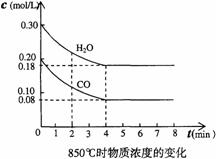
 (2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应: CO(g)+H2O(g)
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应: CO(g)+H2O(g) CO2(g)+H2(g)+Q(Q>0)
CO2(g)+H2(g)+Q(Q>0)
CO和H2O浓度变化如右图,则0-4min的平均反应速率v(CO)=______mol/(L·min)
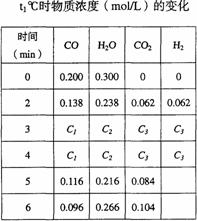
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min-4min之间反应处于_________状态;
C1数值________0.08mol/L(填大于、小于或等于)。
 ②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是________(单选)。
②反应在4min-5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是________(单选)。
A 增加水蒸气 B 降低温度
C 使用催化剂 D 增加氢气浓度
26.(全国II理综化学13)在相同温度和压强下,对反应CO2(g)+H2(g)
 CO(g)+H2O (g)进行甲、乙、丙、丁四组实验,,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O (g)进行甲、乙、丙、丁四组实验,,实验起始时放入容器内各组分的物质的量见下表
|
物质的量 |
CO2 |
H2 |
CO |
H2O |
|
甲 |
a mol |
a mol |
0 mol |
0 mol |
|
乙 |
2a mol |
a mol |
0 mol |
0 mol |
|
丙 |
0 mol |
0 mol |
a mol |
a mol |
|
丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
考点8.综合题
25.(2007年江苏一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4
molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4
molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增人
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)

24.(08广东卷)将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
 2HBr(g)
2HBr(g) g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
g平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
23.(2005年江苏)一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)  3C(g),若反应开始时充入2
mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是
3C(g),若反应开始时充入2
mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是
A.2 mol C B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com