
15.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可以表示为( )
A. B3A2 B. BA2 C. A3B2 D. AB2
14.以下物质的制备原理错误的是( )
A. 无水氯化镁的制备 :MgCl2·6H2O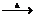 MgCl2+ 6H2O
MgCl2+ 6H2O
B. 钴的制备:3Co3O4+8Al 9Co+4Al2O3
9Co+4Al2O3
C. 烧碱的制备:2NaCl+2H2O 2NaOH +H2↑+ Cl2↑
2NaOH +H2↑+ Cl2↑
D. 漂粉精的制备: 2Ca(OH)2+ 2Cl2→Ca(ClO)2 +CaCl2+2H2O
13.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50 mLb mol·L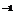 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴人硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe
C.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe 、Cu
、Cu 时,则a与b的关系为:b≥80y(1一
时,则a与b的关系为:b≥80y(1一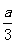 )
)
12.下列溶液中各微粒的浓度关系不正确的是
A.0.1
mol·L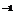 HCOOH溶液中:c(HC00
HCOOH溶液中:c(HC00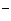 )+
c(OH
)+
c(OH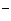 )=c(H
)=c(H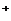 )
)
B.1 L O.1mol·L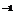 CuS0
CuS0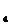 ·(NH
·(NH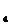 )
) S0
S0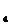 ·6H
·6H 0的溶液中:
0的溶液中:
c(SO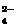 )> c(NH
)> c(NH )> c(Cu
)> c(Cu )> c(H
)> c(H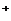 )> c(OH
)> c(OH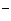 )
)
C.0.1 mol·L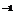 NaHCO
NaHCO 溶液中:
溶液中:
c(Na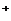 )+c(H
)+c(H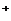 )+ c(H
)+ c(H CO
CO )
) c(HCO
c(HCO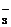 )+ c(C0
)+ c(C0 )+ c(OH
)+ c(OH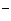 )
)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na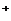 )> c(HX)> c(x
)> c(HX)> c(x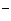 )> c(H
)> c(H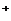 )> c(OH
)> c(OH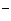 )
)
11.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH) 为强碱,则Y(0H)
为强碱,则Y(0H) 也一定为强碱
也一定为强碱
B.若H X0
X0 为强酸,则X的氢化物溶于水一定显酸性
为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是 ,则Y元素形成的单质一定是Y
,则Y元素形成的单质一定是Y
D.若Y的最高正价为+m,则X的最高正价一定为+m
10.花青苷是引起花果呈现颜色的一种花色素,广泛存在于植物中。它的主要结构在不同pH条件下有以下存在形式:
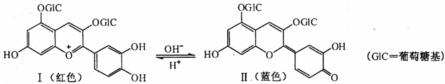
下列有关花青苷说法不正确的是
A.花青苷可作为一种酸碱指示剂 B.I和Ⅱ中均含有二个苯环
C.I和Ⅱ中除了葡萄糖基外,所有碳原子可能共平面
D.I和Ⅱ均能与FeCl3溶液发生显色反应
9.下列离子方程式书写正确的是
A.过量的S02通入NaOH溶液中:SO2+2OH-1 SO32-+H2O
SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- 2Fe2++I
2Fe2++I
C.NaNO2溶液中加入酸性KMnO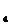 溶液:2MnO4-:+5NO2-+6H+
溶液:2MnO4-:+5NO2-+6H+ 2Mn2++5NO3-+3H2O
2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2:溶液:
2HCO3-+Ba2++2OH- BaCO3↓+2H2O+CO32-
BaCO3↓+2H2O+CO32-
8.阿伏加德罗常数约为6.02×1023 mol-1 ,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1 L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×l023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
7.甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是
①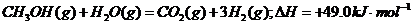
②
 下列说法正确的是
下列说法正确的是
A.CH30H的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应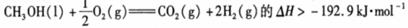
6.向存在大量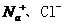 的溶液中通入足量的
的溶液中通入足量的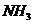 后,该溶液中还可能大量存在的离子组是
后,该溶液中还可能大量存在的离子组是
A.K+、Br-、CO32- B.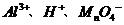
C.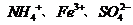 D.
D.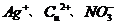
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com