
1.已知集合A={x|x-m=0},B={x|mx-1=0},若A∩B=B,则m等于
A.1 B.0或1 C.-1或1 D.0或1或-1
33.(16分)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
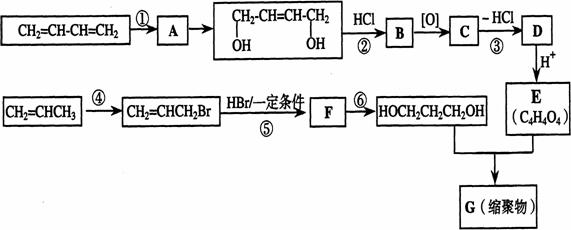
请完成下列各题:
(1)写出反应类型:反应① ,反应④ ,
(2)写出反应条件:反应③ ,反应⑥ ,
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式 。
32.(17分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3 + 24NaOH +7KClO3 12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
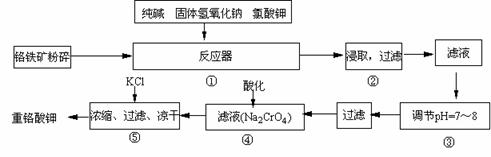
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:
;
。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
。
(3)操作③的目的是什么,用简要的文字和化学方程式说明:
。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.500 g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入10.00 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5 min,然后加入100.0 mL水,加入3 mL淀粉指示剂,用0.120 0 mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其他杂质不参与应) 。
31.(15分)
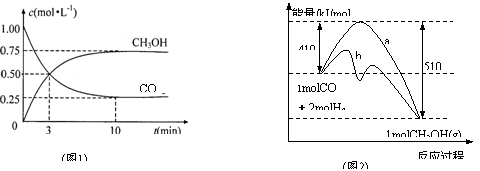 工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________ (选填“吸热”或“放热”)反应,写出反应的热化学方程式 ;选择适宜的催化剂, ______(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表达式为 ,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的有______。
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
30. (16分)硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:
(16分)硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
|
温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是__________;
(2)写出浸出过程中生成硫酸铜的化学方程式 ;
(3)操作I的操作温度应该控制在________℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为____________________、洗涤、干燥;
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是__________;
②指出你认为不合理的方案存在的问题_____________________________;
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
。
23.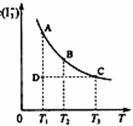 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
 I3-(aq)
, 某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3-(aq)
, 某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
A.反应I2(aq)+I-(aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
22.下列化学实验事实及其解释都正确的是( )
 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
 C.向0.1
mol·L-1FeSO4溶液中加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具氧化性
C.向0.1
mol·L-1FeSO4溶液中加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具氧化性
 D. 向2.0
mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01
mol·L-1AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl的KSP比AgI的KSP大
D. 向2.0
mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01
mol·L-1AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl的KSP比AgI的KSP大
12.已知:2H2S+SO2=3S↓+2H2O。某同学向100 mL氢硫酸溶液中通入标准状况下的二氧化硫气体,所得溶液pH变化如图所示。他据此得到的下列四条关于二氧化硫和亚硫酸的说法。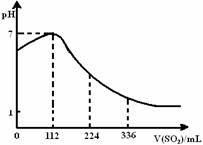 请分析其中正确的是( )
请分析其中正确的是( )
A.SO2是弱电解质
B.H2SO3不是强酸
C.亚硫酸是比氢硫酸还弱的酸
D.原氢硫酸溶液的物质的量浓度0.05 mol·L-1
11.向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之
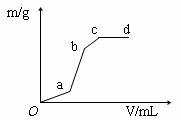 间的关系,关于下图曲线的推测正确的是( )
间的关系,关于下图曲线的推测正确的是( )
A.ab段产生的沉淀为硫酸钡
B.ab产生段的沉淀为氢氧化镁
C.bc段产生的沉淀为氢氧化镁
D.bc段产生的沉淀为硫酸钡和氢氧化镁
9.下列离子方程式书写正确的是( )
A.少量金属钠加到冷水中:Na+2H2O==Na++OH-+H2↑
B.往氨水中滴加氯化铝:Al3++4OH-==AlO2-+2H2O
C.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-==3Fe3++NO↑+2H2O
D.苯酚钠溶液中通入少量二氧化碳:2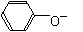 +CO2+H2O
+CO2+H2O 2
2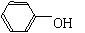 +CO32-
10.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4 +8H2O
+CO32-
10.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4 +8H2O  3Zn(OH)2
+2Fe(OH)3 +4KOH。下列叙述不正确的是( )
3Zn(OH)2
+2Fe(OH)3 +4KOH。下列叙述不正确的是( )
A.放电时锌做负极 B.充电时氢氧化铁被氧化 C.放电时溶液的碱性增强 D.放电时转移3 mol e-,有2 mol FeO42-被还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com