
2、硫酸的性质
浓硫酸的特性:
⑴吸水性:作干燥剂,不能干燥碱性气体NH3
⑵脱水性:蔗糖的炭化 浓硫酸滴到皮肤上处理:先用抹布抹去。再用大量的水冲洗
(3)浓硫酸的强氧化性:
①与铜反应:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O 被还原的硫酸占反应硫酸的1/2
CuSO4+SO2↑+2H2O 被还原的硫酸占反应硫酸的1/2
②与碳反应:C+2H2SO4(浓) SO2↑+ CO2↑+2H2O
SO2↑+ CO2↑+2H2O
常温下,浓硫酸使铁铝钝化


|
|
|


|
|

|
 O2 O2
H2O
NaOH
O2 O2
H2O
NaOH
O2 BaCl2
1、接触法制硫酸
原理:(1)硫磺与氧气反应生成SO2 : S+O2=SO2
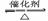 (2)SO2与氧气反应生成SO3 : 2SO2+O2
2SO3
(2)SO2与氧气反应生成SO3 : 2SO2+O2
2SO3
(3)SO3转化为硫酸 : SO3+H2O=H2SO4
3、酸雨:PH<5.6 正常性雨水PH值大约为6 ,水中溶解有CO2。
硫酸性酸雨的形成原因: SO2
来源:(主要)化石燃料及其产品的燃烧。(次要)含硫金属矿物的冶炼、硫酸厂产生的废气
防治:开发新能源,对含硫燃料进行脱硫处理,提高环境保护的意识。
常见的环境保护问题:酸雨:SO2; 温室效应:CO2 ; 光化学烟雾:NO2 ; 臭氧层空洞:氯氟烃 ;白色垃圾:塑料垃圾; 假酒:CH3OH ;室内污染:甲醛 ; 赤潮:含磷洗衣粉; CO 与NO与血红蛋白结合而中毒。 电池:重金属离子污染。
2、化学性质
(1)与水反应 SO2+H2O=H2SO3 可逆反应 H2SO3的不稳定性2H2SO3 +O2=2H2SO4
 (2)还原性 2SO2+O2
2SO3
(2)还原性 2SO2+O2
2SO3
(3)漂白性:SO2 能使品红溶液褪色 原理:与有色物质结合生成无色物质,该物质不稳定 (暂时性漂白)。 而氯水具有永久性漂白, 原理:HClO 具有强氧化性。
1、物理性质:无色有刺激性气味的有毒气体,密度比空气大。
2.硅的物理性质:晶体硅呈现灰黑色,有金属光泽硬而脆的固体。
SiO2+2C=2CO↑+Si(粗硅) Si+2Cl2=SiCl42 SiCl4+2H2=Si+4HCl
专题四 硫、氮
1.SiO2化学性质: 不活泼,耐高温耐腐蚀。
①不与水酸(除HF)反应SiO2+4HF=SiF4↑+2H2O 玻璃瓶不能装HF酸
②与碱性氧化物反应SiO2+CaO=CaSiO3
③与碱反应SiO2+2NaOH=Na2SiO3+H2O 实验室装NaOH的试剂瓶用橡皮塞
硅元素在自然界以SiO2及硅酸盐的形式存在,知道晶体硅是良好的半导体材料
3. 电化学保护法
9. 铁及其物质的转化关系
HCl
FeCl2
铁及其物质的转化关系
HCl
FeCl2


 Fe
Fe
Cl2 金属防腐的方法 2.改变内部结构
Fe
Fe
Cl2 金属防腐的方法 2.改变内部结构
Cl2 FeCl3
8.钢铁的腐蚀: 钢铁与周围物质接触发生反应而被侵蚀损耗。
 电化学腐蚀: 不纯金属接触电解质溶液产生微电流而发生氧化还原反应。 1.表面覆盖保护层
电化学腐蚀: 不纯金属接触电解质溶液产生微电流而发生氧化还原反应。 1.表面覆盖保护层
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com