
1、乙烯分子式:C2H4 结构简式:CH2==CH2 结构式:
空间构型: 6个原子在同一平面上
2、化学性质
一般情况下,性质稳定,跟强酸、强碱或强氧化剂不反应
(1)、氧化性
CH4+2O2 CO2+2H2O;△H<0
CO2+2H2O;△H<0
CH4不能使酸性高锰酸钾溶液褪色
(2)、取代反应
取代反应:有机化合物分子的某种原子(或原子团)被另一种原子(原子团)所取代的反应
CH4+Cl2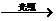 CH3Cl+HCl
CH3Cl+Cl2
CH3Cl+HCl
CH3Cl+Cl2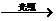 CH2Cl2+
HCl
CH2Cl2+
HCl
CH2Cl2+Cl2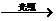 CHCl3+
HCl CHCl3+Cl2
CHCl3+
HCl CHCl3+Cl2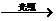 CCl4+
HCl
CCl4+
HCl
(3)主要用途:化工原料、化工产品、天然气、沼气应用
1、结构:分子式:CH4 结构式:
电子式: 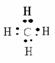
空间构型:正四面体
甲烷三存在:沼气、坑气、天然气
化石燃料:煤、石油、天然气
 天然气的主要成分:CH4
天然气的主要成分:CH4
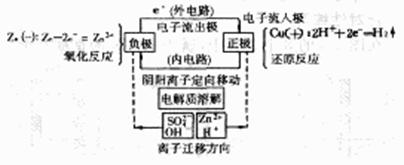
原电池:
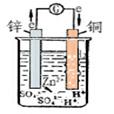
定义:将化学能转化为电能的装置。
原理:氧化还原反应。
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属或非金属导体(正极)。
电极反应(以锌-铜原电池为例):
负极: Zn-2e==Zn2+
正极: 2H++2e=H2↑
总反应:Zn+2H+==Zn2++H2↑
专题七 有机化合物
2.吸热反应:化学上吸收热量的化学反应 。 生成物的总能量>反应物的总能量。
断开化学键所吸收的能量大于形成化学键所放出的能量。
①常见的放热反应:所有的燃烧、酸碱中和反应、金属与酸、碱的反应、氧化钙与水等大多数化合反应。
②常见的吸热反应:通常需要高温或者加热的反应(CO或C与CO2高温下的反应)、氢氧化
钙与氯化铵晶体反应、H2还原CuO的反应,大多数分解反应等。
燃烧放出的热量的大小等于断裂开反应物分子中化学键吸收的总能量与形成生成物分子中化学键放出的总能量之差。
1.放热反应:化学上有热量放出的化学反应。 反应物的总能量>生成物的总能量 。
断开化学键所吸收的能量小于形成化学键所放出的能量。
2.影响化学反应速率的因素
(1)内因:反应物的性质(主要)
(2)外因 其他条件不变时
①温度:温度越高反应速率越快
②压强:对于有气体参加的反应,增加压强化学反应速率越快
③浓度:浓度越大反应速率越快
④催化剂:使用正催化剂化学反应速率增大
其他:反应接触面积的大小、固体反应物的颗粒大小、光照、超声波、电磁波、溶剂等对反应速率也有影响。
化学反应限度
可逆反应:在同一条件下,既可以想正反应方向进行,同时又可以想逆反应方向进行。可逆反应有一定限度,反应物不可能完全转化为生成物。
例如:Cl2+H2O 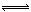 HCl+HClO
2Fe3++2I-
HCl+HClO
2Fe3++2I- 2Fe2++I2
2Fe2++I2
化学平衡状态:在一定条件下的可逆反应里,当正反应速率等于逆反应速率,反应物和生成物的浓度不在变化的状态
特征:
动:动态平衡 V正≠0, V逆≠0
等:V正=V逆
定:各组分的浓度保持不变(不是相等,也不能某种比例)
变;条件改变,平衡发生移动
1. 定义:化学反应速率是用来衡量化学反应进行 快慢 的物理量,
常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,其数学表达式可表示为 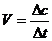 单位 moL/(L·s)
单位 moL/(L·s)
注意:各物质表示的速率比等于该反应方程式中相应的计量系数比
8.同分异构体:分子式相同结构式不同的化合物互称
 C4H10 CH3CH2CH2CH3 CH3CHCH3 异丁烷
C4H10 CH3CH2CH2CH3 CH3CHCH3 异丁烷
 正丁烷
CH3
CH3
正丁烷
CH3
CH3

 C5H12
CH3CH2CH2 CH2 CH3 CH3CHCH2
CH2
CH3C CH3
C5H12
CH3CH2CH2 CH2 CH3 CH3CHCH2
CH2
CH3C CH3
戊烷 CH3 CH3
2-甲基丁烷 2,2-二甲基丙烷
专题六 化学反应速率、化学平衡及电化学
化学反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com