
12.(14分)某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质。(所给装置必须用到并只能用一次,各装置中的试剂均足量)
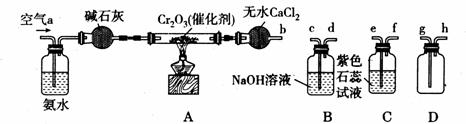
(1)装置的连接顺序为(用a、b、c、d等字母表示);
b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式 。
(3)进行实验时,装置A中碱石灰的作用是 ;D中的现象是
。
(4)能证明有硝酸生成的现象是 。
(5)实验开始时,下列操作顺序最合理的是 。
a.先加热A装置中的催化剂,再由导管a通入空气
b.先由导管a通入空气,再加热A装置中的催化剂
c.在由导管a通入空气的同时,加热A装置中的催化剂
11.(16分)北京时间2004年10月6日18时,瑞典皇家科学院将2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,三人共享1000万瑞典克朗(约合136万美元)的奖金,以表彰他们发现了泛素调节的蛋白质降解。
用泛素标记的某天然蛋白质降解产物中含有甘氨酸、丙氨酸、A和M四种α-氨基酸,其中A由C、H、N、O四种元素组成,A能与NaOH反应,也能与盐酸反应。在一定条件下,两分子A发生缩合反应生成B和1个水分子,B的相对分子质量为312,当该蛋白质与浓硝酸反应时显黄色。M中各元素的质量分数为C 54.8%,H 5.58%,N 7.11%,其余为O。M的相对分子质量不超过300,分子中不存在甲基,能与FeCl3溶液发生显色反应,l mol M最多能与3 mol NaOH完全反应。
(1)据此推断A的结构简式为 。
(2)有机物M的相对分子质量为 ,其分子式为 ,符合上述条件的有机物M的可能结构有 (填数字)种,写出其中任意一种与NaOH溶液完全反应的化学方程式 。
(3)已知α-氨基酸能与亚硝酸反应得到α-羟基酸,例如:



 O O
O O

 R―CH―C―OH + HNO2 → R―CH―C―OH + N2↑+H2O
R―CH―C―OH + HNO2 → R―CH―C―OH + N2↑+H2O
NH2 OH
现有某α-氨基酸盐A,其分子中原子数之比为C∶H∶O∶N = 3∶10∶2∶2,由它开始有如下图所示的反应关系,其中无机产物均已略去,括号中的数字为其相对分子质量。
|
 |
|||
|
|||
|
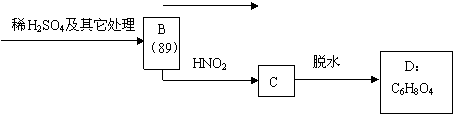
①写出下列有机物的结构简式:
D E
②写出A → B的化学方程式:
10.(15分)已知下列反应的框图中,B、E、F、1分别代表一种单质,A、C、D是氧化物,H、G是盐类,水作为反应物或产物时均略去不写,据图分析回答问题。
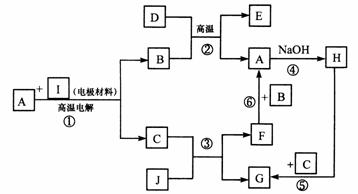
(1)B单质是 。
(2)说出反应②和③的实际应用的例子:②可应用于 ;
③可应用于 。
(3)写出反应③的离子方程式 ;
写出反应④的离子方程式 ;
写出反应⑤的离子方程式 。
9.(15分)已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B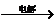 M+D+E;②M+E
M+D+E;②M+E A+F+B。请针对以下两种不同情况来完成:
A+F+B。请针对以下两种不同情况来完成:
(1)若A是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为___________________;
反应②的离子方程式为__________________________________;在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为________
_______________________________________。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层数的2倍,则X在元素周期表中的位置是____________。X单质的熔点是112.8 ℃,则X单质的晶体类型属于____________晶体。
(3)若A是(2)中的含氧酸盐,当以石墨作电极电解A溶液时,电流强度为a A,时间t min后阴极增重w g,在阳极得V L纯净气体,则阿伏加德罗常数NA的计算式是(1个电子的电量为q C)________________。
8.某温度下,溶液中c(H+)•c(OH―)=1×10―12。在一定体积 pH=10的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,溶液的pH=9。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
第Ⅱ卷 (非选择题 共60分)
7. 在一恒容密闭容器中发生某化学反应2A(气) B(气)+C(气)。在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度
在一恒容密闭容器中发生某化学反应2A(气) B(气)+C(气)。在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度
(mol•L―1)随时间(min)变化如图所示。下列叙述中正确的是
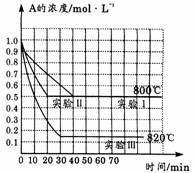 A.在实验I中,反应在20 min-30 min内A的平均反应速率为0.02 mol•L―1•min―1
A.在实验I中,反应在20 min-30 min内A的平均反应速率为0.02 mol•L―1•min―1
B.实验Ⅱ和实验Ⅰ比较,可能隐含的反应条件是加压
C.根据实验Ⅲ和实验Ⅰ比较,可推测正反应是吸热反应
D.与实验Ⅰ比较,如果将实验Ⅰ中A的起始浓度改为1.2 mol•L―1,其他条件不变,则达到平衡时,所用的时间大于实验Ⅰ
6.取等质量的单质A和化合物B两种固体,分别投入足量的水中,产生C、D两种气体。一定条件下,C和D恰好可完全反应,则下列叙述中正确的是
A.1 mol A和1 mol B的质量相同 B.1 mol A和1 mol B中所含的质子数相同
C.1 mol A和1/2 mol B所含的电子数相同
D.1/2 mol A和1 mol B中所含的中子数相同
5.聚乙炔导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,当聚乙
炔分子带上药物、氨基酸、糖基等分子片后,就具有一定的生物活性。以下是我国化学家
近年来合成的一些聚乙炔衍生物分子的结构式:(Me指甲基)
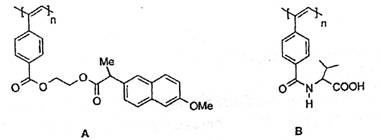
下列关于上述高分子的说法不正确的是
A.A和B均能在一定条件下水解,且水解形成相同的高分子
B.A中药物小分子羧酸的分子式为C16H18O4
C.B中氨基酸为2-氨基-3-甲基丁酸
D.A和B各1mol与热碱液反应,均最多消耗2n mol NaOH
4.下列加入的“物质”,起催化作用的是
A.电解水时,加入少量“KOH” 电解速率加快
B.Zn与稀硫酸反应时,加入几滴“CuSO4”溶液产生H2的速率加快
C.双氧水中加入“MnO2”粉末,产生的气泡明显增多
D.Fe粉与浓硝酸的混合物中,加入一定量“H2O”,观察到有大量气泡产生
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com