
10.B解析: 氯水中:c(Cl2)= 2c(ClO-)+2c(Cl-)+2c(HClO),A错;25℃时,pH=12的NaOH溶液与pH=12的氨水中:c(Na+)= c(OH-)= c(NH4+)=0.01 mol· ·L-1,B错;pH=4的0.1 mol· ·L-1的NaHA溶液中:c(HA-)>c(A2-) >c(H+)>c(H2A),C错;等物质的量的K2CO3、KHCO3的混合溶液中:由电荷守恒得:2c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+ c(K+),由物料守恒得:2c(K+)=3[c(CO32-)+ c(HCO3-)+ c(H2CO3)],则c(CO32-)+2c(OH-)=c(HCO3-)+2c(H+)+ c(H2CO3) +3c(H2CO3),D错。
10.下列溶液中有关粒子的物质的量浓度关系正确的是 ( )
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水中:c(Na+)= c(NH4+)
C.pH=4的0.1 mol· ·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.等物质的量的K2CO3、KHCO3的混合溶液中:
c(CO32-)+2c(OH-)=c(HCO3-)+c(H2CO3)+2c(H+)
9.D解析:甲池两电极是材料不同的金属,乙池中两电极都为石墨,当 K 闭合时,在交换膜处 SO42一从右向左移动,则甲池为原电池,乙池为电解池。 M是原电池的负极,K闭合后,M溶解,甲池溶液中M2+浓度增加,A正确;N是原电池正极,电极反应为N2+ +2eˉ= N,B正确;y是电解池的阳极且电极上有:2Clˉ-2eˉ=Cl2↑,发生氧化反应,C不正确;x 是电解池的阴极且电极上有:2H2O +2eˉ= H2↑+2OH-,Al3+在碱性环境下,先生成Al(OH)3白色沉淀,后随着x电极区域的OH-浓度不断增加,生成的Al(OH)3沉淀又溶解,D正确。
9.某同学按右图所示的装置进行实验。 M、N为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析正确的是 ( )
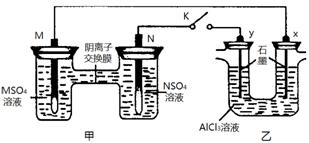
A.甲池溶液中M2+浓度减小
B.甲池中N 的电极反应: N-2eˉ=N2+
C.y 电极上有 H2 产生,发生还原反应
D.反应初期, x 电极周围出现白色胶状沉淀,不久沉淀溶解
8.铁氧磁体法处理含Cr2O72-的废水的原理如下:向含Cr2O72-的酸性 废水中加入FeSO4•7H2O,将Cr2O72-还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于
FeII [FeIIIx·CrIII2-x]O4 (铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是 ( )
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8 D.x=1.5,a=10
解析:由电子守恒得,1 mol Cr2O72-得到6mol电子,则亚铁离子必须失去6mol电子,当x=0.5,不论a取8或者10,都不符合题意,只有当x=1.5,a=10,由FeII [FeIIIx·CrIII2-x]O4可知,n(Fe2+)/ n (Fe3+)=2/3,则此时n(Fe3+)=6mol才符合题意。答案:D
说明:注重绿色环保,运用电子守恒解答。
7.C解析:在常温下pH=7的溶液中:Fe3+与氢氧根离子发生沉淀;常温下c(OH-)/c(H+)=1014的溶液中:即在碱性条件下,Mg2+与氢氧根离子发生沉淀;能与金属铝反应放出氢气的溶液中:可能是酸溶液,4H++NO3-+3Fe2+=3Fe3++NO↑+2H2O,也可能是碱溶液,Fe2+与氢氧根离子发生沉淀。
说明:在不同的介质中,考查常见离子可能发生的变化。特别是在存在HCO3-的澄清透明溶液中,几种离子存在形式,能与金属铝反应放出氢气的溶液可能是酸溶液,或者是强碱溶液,看几种离子存在形式。
7.在下列各溶液中,一定能大量共存的离子组是 ( )
A.常温下pH=7的溶液中:Fe3+、Na+、Cl-、NO3-
B.常温下c(OH-)/c(H+)=1014的溶液中:K+、Mg2+、Cl-、Br-
C.含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+
D.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+
6.A解析:NO2溶于水且与水反应生成NO,A正确;铁制品表面镀锌应用含Zn2+的电解质溶液作电解液,B不正确;浓硫酸稀释应先在烧杯稀释且冷却到室温后才能转移到容量瓶中,C不正确;Na2O2 与水作用后不能保持块状,Na2O2不适合用启普发生器来制备氧气,D不正确。
6.下列实验装置、试剂选用或操作正确的是
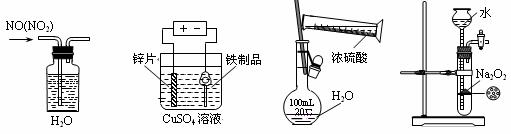
A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
5.C解析:X、Y和Z分别为:N、Mg和S,则NH3溶于水显碱性,A错; X与Y形成化合物的化学式为Mg3N2,B错;MgO是离子化合物,C正确;HNO3和H2SO4都是强酸,D错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com