
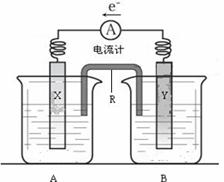
23.(12分)右图是铜锌原电池装置。其电池的总反应是:
 Zn(s) + CuSO4(aq)==
ZnSO4(aq) +
Cu(s)。
Zn(s) + CuSO4(aq)==
ZnSO4(aq) +
Cu(s)。
请回答以下问题:
⑴R的名称是__________________,R中的阳离子移向_______(填A或B)中的溶液
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的______极,其电极反应式是____________________________。
第Ⅱ卷 (共50分)
注意:将第Ⅱ卷的选择题答案按照题号正确添涂在机答卡上
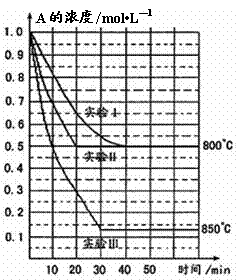
22.(14分)在一恒容密闭容器中发生某化学反应2A(g)  B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为
mol·L-1min-1。
(2)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向 (填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(3)若将实验Ⅰ中A的起始浓度改为0.8 mol·L-1,其它条件不变,与实验Ⅰ相比,则达平衡时所需时间________实验Ⅰ(填写“大于”、“等于”或“小于”)。
(4)实验Ⅱ和实验I相比,可能隐含的反应条件是____________________。
A.升高温度 B.增大压强 C.使用了催化剂 D.增大A的浓度
(5)800℃时,A达平衡时的转化率为 ,此温度下该反应的化学平衡常数K值为 。
21.(14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g) △H = +67.7 kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”), H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
 ③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
20. 对于mA(s) +
nB(g)
对于mA(s) +
nB(g) 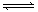 eC(g) +
f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,
eC(g) +
f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,
下列叙述正确的是
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡逆向移动
C.化学方程式中n<e +f
D.达到平衡后,增加A的量,平衡正向移动
19.恒容密闭容器中进行的可逆反应2NO2(g)  2NO(g)+O2(g),不能说明该反应达到平衡状态的是
2NO(g)+O2(g),不能说明该反应达到平衡状态的是
A.单位时间内生成n mo1 O2的同时生成2nmol NO2
B.混合气体的颜色不再改变
C.混合气体的密度不再改变的状态 D.混合气体的压强不再改变的状态
18.下列图示中关于铜电极的连接错误的是
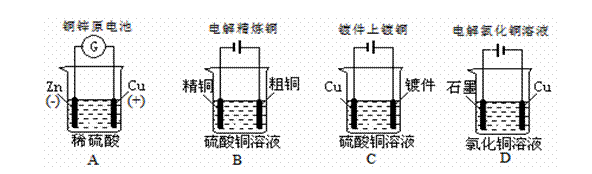
17.下列事实不能用勒夏特列原理解释的是
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅。
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅。
B.对CO(g)+NO2(g)
 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。
CO2(g)+NO(g),平衡体系增大压强可使颜色变深。
C.升高温度能够促进水的电离。
D.SO2催化氧化成SO3的反应,往往加入过量的空气
16.下列说法正确的是
A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8
B.给稀醋酸溶液加热,溶液pH值增大
C.pH=1的盐酸中c(H+)是pH=3的盐酸的100倍
D.在H2CO3溶液中,C(H+) :C(CO32--)=2∶1
15.高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,
H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.该反应化学方程式为:CO + H2 O 催化剂高温 CO2 + H2
C.增大压强,H2浓度一定不变
D.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
14. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiOOH+2H2O 由此可知,该电池充电时在阴极上发生反应的是
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiOOH+2H2O 由此可知,该电池充电时在阴极上发生反应的是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiOOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com