
1.唐代诗人刘禹锡在《竹枝》(六)中写道 “杨柳青青江水平, 闻郎江上唱歌声。 东边日出西边雨, 道是无晴却有晴。”词中描写的是二十四节气中的 ( )
A.立春 B.清明 C.夏至 D.秋分
2.下图分别反映了汉、唐、明、清四朝中枢的演变过程,空白处应该填写 ( )
A.三公九卿制 B.三省六部制 C.二府三司制 D.一省制
3.斯大林说:“这次战争和过去不同了:无论谁占领了土地,也就在那里加强它自己的社会制度。不可能有别的情况。”这一言论反映的真实意图是 ( )
A.帮助东欧国家走上社会主义道路 B.苏联要扩展自己的势力范围
C.强制推广高度集中的政治经济体制 D.苏联要与美国建立同盟关系
4.观察右面20世纪70年代漫画“日本相扑好汉要与山姆大叔较量一番”,此漫画反映了 ( )
A.日本要与美国争夺世界霸权
B.美国由单独占领到扶植日本
C.日本想要谋求政治大国地位
D.美国国际地位走向下降趋势
5.在1971年第26届联大上,由于第三世界国家的支持,中国得以冲破美国设置的种种障碍,恢复了联合国的合法席位。这里“第三世界国家”应该指的是 ( )
A.美苏两个超级大国外所有国家 B.两大社会阵营外的国家
C.社会主义阵营的所有成员国家 D.亚非拉的民族独立国家
6.20世纪80年代末90年代初两极格局瓦解,世界形势呈现出 ( )
①多极化趋势不断加强 ②缓和与动荡并存的局面
③新旧格局交替的局面 ④和平与发展成为时代主流
A.①②③ B.①②④ C.①③④ D.①②③④
7.据《齐民要术》记载,我国6世纪粟的收获量为播种量的24-200倍,麦类则为44-200倍。《补农书》也曾提到,明末清初浙江嘉兴、湖州地区水稻最高产量可达4-5石(合今每市亩910-1125斤),比二十世纪末美国加州的产量还高。这主要是因为中国古代
( )
A. 铁犁牛耕技术非常发达 C. 水利灌溉技术领先于世界
B. 农业精耕细作技术发达 D. 耕作者的辛勤劳动与智慧
28、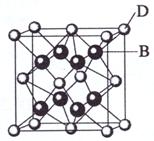 (共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。请回答:
(共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。请回答:
(1)写出B的电子排布图 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是 ;
(2)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 :
(3)写出C的单质与水反应的化学方程式 ;
(4)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
哈三中2009--2010学年度下学期高二学年
第二学段考试
27、(共14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) (1)AC2在H2C(C的氢化物)中的溶解度不大,其主要原因是 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。 (3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。 (4)向ESO4中逐滴加氨水至氨水过量,其现象为 ;产生此现象的原因(用离子方程式表示) ; 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
26、(共17分)下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑩的元素符号是______和_______;
(2)表中最活泼的金属是____,非金属性最强的元素是____;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__ _____,(填写元素符号)分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:_________________ ____ ; _______;
(4)⑤和⑦形成只含一个中心原子的化合物a,a的分子式是__ ____;a分子的立体结构是__ _;a是含_ _____键(填“极性”或“非极性”)的____ __分子;(填“极性”或“非极性”)
(5)③和④比较,电负性较大的是______;第一电离能较大的是______(填元素符号),其第一电离能较大的原因是 。
25、(共6分) 以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是 ;
(2)既含有极性键又含有非极性键的是 ;
(3)属于极性分子的是 ;
(4)既有σ键又有π键的是 ;
(5)含有s-sσ键的是 ;
(6)以上物质为固体时,属于离子晶体的是 。
24、下列有关数据的比较,不正确的是
A.元素的价电子数和所在族的族序数相等
B.钠、钾、铷的第一电离能逐渐减小
C.CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相同
D.(Co(NH3)6)3+中配体为NH3,中心离子为Co3+
23、下列物质中微粒的个数比不是1 : 1的是
A.NaHCO3晶体中的阴离子和阳离子 B.Na2O2固体中的阴离子和阳离子
C.重氢原子中的质子和中子 D.NH3分子中的质子和电子
22、下列是一些化学键的键能。
|
化学键 |
C-H |
C-F |
H-F |
F-F |
键能/(kJ·mol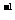 ) ) |
414 |
489 |
565 |
155 |
根据键能数据估算CH4 (g)+4F2 (g) =CF4(g) +4HF(g) 的反应热ΔH为:
A.–1940 kJ · mol-1 B.1940 kJ · mol-1 C.–485 kJ · mol-1 D.485 kJ · mol-1
21、下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
20、下列叙述正确的是
A.离子晶体中只存在离子键
B.在CS2、PCl3分子中各原子最外层均达到8电子的稳定结构
C.由同种元素组成的物质一定是纯净物
D.干冰升华时,分子内共价键会发生断裂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com