
11. 从某铝镁合金上剪下一小片(其质量为2.0g),立即投入盛有20mL 5 mol/L氢氧化钠溶液的烧杯中。
(1)由反应开始到反应结束,可能观察到烧杯中的现象依次为_____________________
______________________________________________________________________________
(2)反应开始时,合金片表面产生气泡较慢,其原因是___________________,一段时间后反应速率相当快,其原因是____________________________________________________
(3)写出合金片与溶液反应时可能形成的微电池的负极材料是_________________,正极的电极反应式:_____________________________________
(4)若要利用该反应来测定合金中铝的质量分数,还应测定哪些数据(如有多种可能,请逐一写出)?答:_________________________________________________________________
_______________________________________________________________________________
本节答案解析与研读
10. 将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:
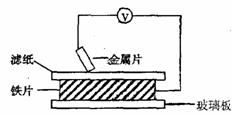
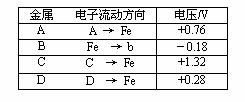
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1)A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2)若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(用字母表示),此时对应的电极反应式为:负极____________________________________
正极___________________________________________
9.市场上出售的“热敷袋”其主要成分为铁屑、炭粉、木屑和少量氯化钠、水等。热敷袋启用之前用塑料袋使其与空气隔绝,启用时打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量铁锈存在。请回答下列问题。
(1)热敷袋产生热量的来源是____________________________________________。
(2)炭粉的主要作用是__________________________________________________。
(3)加入NaCl的主要作用是_____________________________________________。
(4)写出生成铁锈的有关方程式__________________________________________。
(按生成过程分步写,不可合并成总式)
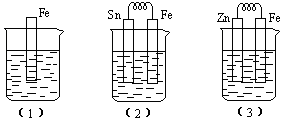
8. 如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ,
(2)中的电极反应:Fe: 、Sn:
Sn极附近溶液的pH(填增大、减小或不变) ,
(3)中被腐蚀的金属是 、其电极反应式为 。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 。
7.锂电池是新一代高能电池,目前已研究出多种锂电池。某种锂电池的总反应式为:Li + MnO2 = LiMnO2。下列说法中正确的是 ( )
A.Li是正极,MnO2是负极
B.放电时负极的反应:Li – e- = Li+
C.放电时正极的反应:MnO2- + e- = MnO2
D.电池放电时,产生高锰酸根离子
6. 某原电池总反应离子方程式为2Fe3+ + Fe = 3Fe2+,能实现该反应的原电池是 ( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
5. 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,
下列有关判断正确的是 ( ) A.负极发生的电极反应可能是:O2+4e-+2H2O=4OH-
B.正极发生的电极反应可能是:O2+4e-=2O2-
C.负极反应主要是C6H12O6生成CO2或 HCO3-
D.正极反应主要是 C6H12O6生成 CO2或 CO32-
4. 在理论上可用于设计原电池的化学反应是 ( )
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g)
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1)
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g)
D.FeCl3(aq)十3H2O(1)  Fe(OH)3(s)+3HCl(aq)
Fe(OH)3(s)+3HCl(aq)
3.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是 ( )
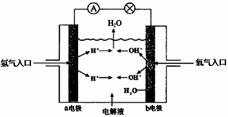
A.a电极是负极
B.b电极的电极反应为:4OH--4 e-=2H2O +O2
C.电池工作时,电子由正极通过外电路流向负极
D.氢氧燃料电池是一种具有应用前景的绿色电源
2.下列各变化中属于原电池反应的是 ( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com