
在19世纪上半叶的五十多年里,从道尔顿到贝采里乌斯,虽然有很多人致力于原子量的测定,但由于对化合物中原子组成比的确定一直没有找到一个合理的解决办法,更主要的是当时对分子和原子的概念尚混淆不清,因而使原子量的测定长期处于极其混乱的状态,陷入了困境。这期间,尽管法国著名化学家杜马(J.B.A.Dumas,1800-1884)曾于1826年发明了简便的蒸气密度测定法,并曾试图利用这一方法,通过测定分子量计算原子量。但因为他虽然
有不同数目的原子”[4]。“他还指出:“……只要我们把分子与原子区别开来,只要我们把用以比较分子数目和重量的标志与用以推导原子量的标志不混为一谈,只要我们最后心中不固执这类成见:以为化合物的分子可以含不同数目的原子,而各种单质的分子却都只能含一个原子或相同数目的原子,那么,它(指阿佛加德罗分子理论,包括安培后来的观点)和已知事实就毫无矛盾之处”[2].康尼查罗正是在明确区分了原子和分子的基础上,通过测定分子量结合物质重量组成分析结果,提出了如下结论:当考虑一系列某一元素的化合物时,其中必然有一种或几种化合物中只含有一个原子的这种元素,那么在一系列该元素的重量值中,最小值就是该元素原子量的约值[2][4][7]。康尼查罗的上述工作,澄清了当时一些错误观点,统一了分歧意见,为原子-分子论的发展和确定扫除了障碍,使得原子-分子论整理成为一个协调的系统,从而大大地推进了原子景的测定工作。对此德国著各化学家迈尔(J.L.Meyer,1830-1895)给予极高的评价[3]。与前人相比,康尼查罗在原子量的测定上没有什么特殊的发现,但由于他决定性地论证了事实上只有一门化学学科和一套原子量,从而在化学发展的重要时刻做出了杰出贡献。
道尔顿首创的确定元素原子相对重量的工作,在当时的欧洲科学界引起了普通的关注和反应。各国的化学家们在充分认识到确定原子量的重要性的同时,对于道尔顿所采用的方法和所得到的数值感到不满和怀疑。于是继他之后,许多人便纷纷投入测定原子量的行列中,使这项工作成为19世纪上半叶化学发展的一个重点。
在这其中,工作非凡,成绩斐然的是瑞典的化学大师贝采里乌斯(J.J.Berzelius, 1779-1848)。这位近代“化学大厦”的卓越建筑师,对近代化学的贡献涉及诸多方面。其中最为非凡的是他用了近二十年的时间,在极其简陋的实验室里测定了大约两千种化合物的化合量,并据此在1814-1826年的12年里连续发表了三张原子量表,所列元素多达49种[5][6]。其中大部分原子量已接近现代原子量数值,这在当时的历史条件下是极其难能可贵的。
贝采里乌斯之所以能在长达近二十年的时间里孜孜不倦、专心致志地从事原子量的测定工作,是因为他高瞻远瞩地认识到这项工作的重要意义。他认为“这就是那时候化学研究最重要的任务”[4]。贝采里乌斯测定原子量的方法与道尔顿相似,但他的基准选定氧= 100。对于化合物组成,他也采用了最简单比的假定。与道尔顿不同的是,他在坚持自己亲自通过实验测定化含量的同时,时时注意吸取他人的科研成果。比如像盖·吕萨克(L,J.Gay.Lussac, 1778-1850)的气体反应体积简单比定律;杜隆(P.L.Dulong, 1785-1838)和培蒂(A,T,peiit,1791-1820)的原子热容定律以及他的学生米希尔里希(E.E. Miischerlich,1794-1863)的同晶型规律等。大约在1828年,贝采里乌斯结合原子热容定律和同晶型定律把他长期弄错的钾、钠。银的原子量纠正过来。正是由于他能够博采众长,持之以恒,才得出了比较准确的原子量,以自己的辛勤劳动为后来门捷列夫发现元素周期律开辟了道路,在化学发展史上写下了光辉的一页。
英国著名的化学家道尔顿(J.Dalton,1766-1844)在提出原子论观点的同时,就为确定不同元素原子的相对重量作了努力。从而成为化学史上测定原子量的第一人,成为这一领域的拓荒者。在当时的历史条件下,要确定各种元素的相对重量并非易事。这首先要确立一个相对标准,既以谁为参照基准。其次要有准确的定量分布手段,并且要明确单质和化合物分子中元素原子的数目,这在当时对于大多数化合物是很难做到的。正是由于这个原因,道尔顿只能采用主观武断的方法规定不同元素的原子化合形成化合物的原子数目比。例如,他认为水是由1个氧原子和1个氢原子组成的。这祥,根据当时拉瓦锡(A .L. Lavoisier,1743-1794)对水的重量分析的结果,以他选择的氢原子的相对重量 为1做基准,算得氧原子相对重量为5.5。
1803年10月21日,道尔顿在曼彻斯特的 “文学和哲学学会”上阐述他的原子论观点时,第一次公布了6种元素的原子相对重量,但他没有宣布数据的实验根据。此后,他又先后于1808年、1810年、1827年在其著名的《化学哲学新体系》一书的第一、二卷中不断增加元素种类,使之最终增至37种,并对部分数值做了修正……。由于道尔顿以主观武断的方式确定物质的组成,因而所得的原子相对重量都与今天的原子量相差甚远。尽管如此,他的这项极富开性和科学性,使之一直沿用至今.更重要的是他的这项工作在当时为广大化学工作者找到了正 确的前迸方向,使得化学科学向系统化、理性化迈进了一步。正如恩格斯指出:“在化学中特别是由于道尔顿发现了原子量,现已达到各种结果都具有了秩序和相对的可靠性,已经能够有系统地、差不多是有计划地向还没有被征服的领域进攻,就象计划周密地围攻一个堡垒一样”[4]。
16.0000×99.759%+17.0045×0.037%+18.0049×0.204%=16.0044
这样一来物理上采用的原子量与化学上沿用的原子量就出现了下列比值:
16,0044/16=1.000275
化学原子量单位= 1.000275×物理原子量单位化学原子量单位要比物理原子量单位大万分之三。这样一来使各种元素的化学原子量数值比物理原子量数值小。因此化学原子量与物理原子量之间的换算关系为:
物理原子量=1.000275×化学原子量
为了求得原子量基准的统一,1959年国际纯粹与应用化学联合会(IUPAC)在德国慕尼黑开会,会上根据德国物理学家马托赫(1895-1976)的建议改用工12C=12 (即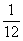 12 C=1)作为原子量基准,并经得国际纯粹与应用物理联合会(IVPAP)的同意于1961年8月正式采用12 C=12作为原子量的基准。同年发布了新的原子量表。
12 C=1)作为原子量基准,并经得国际纯粹与应用物理联合会(IVPAP)的同意于1961年8月正式采用12 C=12作为原子量的基准。同年发布了新的原子量表。
采用12C= 12作为原子量新基准的原因主要是12C在自然界中丰度比较稳定,碳的化合物特别是有机化合物繁多,它形成很多高质量的“分子离子”和氢化物利于测定质谱,而用质谱仪测定原子量是现代最准确的方法。采用新的12 C= 12基准后所有元素的原子量变动都不大,仅比过去减小了百万分之四十三。
到目前为止,用质谱法测定原子量是最精确的,现在国际原子量委员会每两年公布一次修订的原子量,越来越多地采用质谱法测定的结果。
我国著名化学家,中科院院士,北京大学张青莲教授是我国参加国际纯粹与应用化学联合会、原子量与同位素丰度委员会委员。张青莲等人于1991、1993、1995年测定的铟、锑、铈、铕的原子量被国际上采用为原子量数据标准。这是我国化学家对原子量测定工作作出的贡献。
3.求出一分子中各种含氮化合物氮的含量,其中最小值即为氮的原子量。如:
|
含氮化合物 |
分子量值 |
氮的百分含量 |
1分子中氮的重量 |
|
氨 |
17.05 |
82.28% |
14.03 |
|
二氧化氮 |
45.66 |
30.49% |
13.90 |
|
氧化二氮 |
44.13 |
65.70% |
28.11 |
|
氧化氮 |
30 |
46.74% |
14.02 |
以上数据中最小值约为14,就是氮的原子量。用这种方法测定原子量即使化合物的分子式不知道,也可求出可靠的原子量。
化学家为了求得精确的原子量值,投入了大量的精力,进行了辛勤的劳动。最早对原子量进行精确测定的化学家是比利时的斯达(1813-1891),他广泛使用当时已经发展起来的各种制备纯净物质的方法将所测物质提纯,所用蒸馏水经过多次蒸馏,把天平的灵敏度提高到0.03毫克。因此,他所测定的一些元素的原子量值与现代值相当接近。1860年,他又提出以氧的原子量为16作为原子量的基准,便于准确测定其他元素的原子量,这一基准在化学上一直用了100年。
以后在原子量精确测定上做出重要贡献的化学家还有美国的理查落(1868-1928),德国的霍尼施米特(1878-1945)
1929年美国乔克和江斯登在天然氧中发现了17O和18O两种同位素。根据1940年比较精确的质谱测定,自然界中三种氧的同位素的丰度为:16O占99.75%;17O占0.037%;18O占0.204%。因此将天然氧作为原子量的基准就出现了问题。当时物理学界随即改用16O为16作为原子量的基准,但化学界仍采用天然氧为16作为原子量的基准。
当用16O=16作为基准时,氧的各种同位素的原子量分别为16O=16.0000,17O=17.0045,18O=18.0049,所以自然界中氧的平均原子量为:
2.测定一系列含氮化合物中氮的百分含量。
1.先将许多可蒸发的氮的化合物用蒸气密度法测定其分于量。
混沌论在化学科学中的最主要的现象是化学振荡(规则的、周期性的化学变化,也称化学钟)和化学湍流(不规则、非周期性的化学变化)。自50年代以来化学振荡在各方面的应用日益广泛,其中在分析化学中应用较多。当体系中存在浓度振荡时,其振荡频率与催化剂浓度间存在依赖关系,据此可测定作为催化剂的某些离子,如10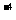 mol/L Ce(III),10
mol/L Ce(III),10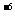 mol/LMn(II),10
mol/LMn(II),10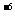 mol/[Fe(Phen)
mol/[Fe(Phen)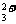 ]等;又如钌化合物在浓度为10
]等;又如钌化合物在浓度为10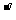 mol/L时可催化 Ce(IV)氧化丙二酸的反应,使 B-Z反应体系振荡频率增大,其振荡频率和钌(III)浓度间存在简单比例关系,从而可测定各种溶液中的钌;还如在 B-Z振荡反应体系中引入微量 Cl
mol/L时可催化 Ce(IV)氧化丙二酸的反应,使 B-Z反应体系振荡频率增大,其振荡频率和钌(III)浓度间存在简单比例关系,从而可测定各种溶液中的钌;还如在 B-Z振荡反应体系中引入微量 Cl ,会阻抑振荡反应,使振荡反应的振幅减小,其减小值与氯离子浓度呈线性关系,可用以测定氯(检出下限可达5×10
,会阻抑振荡反应,使振荡反应的振幅减小,其减小值与氯离子浓度呈线性关系,可用以测定氯(检出下限可达5×10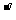 mol/L)。
mol/L)。
此外,在化学振荡基础上发展起来的电化学振荡更广泛地运用于理论研究和应用实践(如仿生学、临床医学等)。人们根据生物膜或人工膜对某些分子(乙醇、糖类、胺等)具有独特的电位振荡特征来模拟味觉、嗅觉的生物过程,作为识别分子的信号来模仿味觉和嗅觉器官,其中味觉传感器的研究在模拟生物膜模型、离子在生物膜中转移机理等仿生学研究领域具有重要意义,在食品检测与控制、环境保护等领域具有广阔的应用前景;脑电波、心电图(电位差振荡)等也在临床诊断和病理研究中获得应用;在生物信息传递方面,根据动物大脑的电位振荡方式对外界刺激所产生的响应建立的神经动力学模型,研究生物神经活动过程,探索人们对动物以及人的大脑活动的认识之谜,从而进一步为人类服务。
总之,化学混沌是一种关于化学过程的科学,是关于化学过程演化的化学。它与传统的经典热力学相互补充,将促进人们对实际、真实的化学过程的研究和认识,必将推动化学乃至其它学科的进一步发展。正如对耗散结构理论研究作出重大贡献的诺贝尔奖获得者普里戈金教授所说的那样:“对我们以自身为尺度的世界的发现才刚刚开始,而且看来从宏观或微观尺度上对世界的探索同样地充满着令人惊奇的事情.”
4.分数维的空间结构:分数维即为非整数维。欧几里德几何是整数维的,而自然界绝大部分是分数维的结构。例如:海岸线的长度,取决于测量时所用尺的长度大小,如用的尺越小,可测量到更多曲折的地方。海岸线的长度是无限可分的,混吨的空间结构也是无限可分的。
3.灵敏初条件:真实的化学过程初始条件的微弱差异,会引起结果巨大不同的化学混沌过程。即化学混沌对初始条件是敏感的,因此称为灵敏初条件。用天文气象的“蝴蝶效应”来形象地比喻就是:今天在北京城上空一只小蝴蝶飞翔时搅动了空气就会某时在纽约形成狂风暴雨。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com