
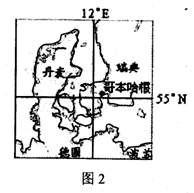
丹麦哥本哈根召开。结合图2回答3-4题。
3.丹麦的农业地域类型主要为 ( )
A.商品谷物农业
B.乳畜业
C.大牧场放牧业
D.季风水田农业
4.以下叙述正确的是 ( )
A.大会17日10时开幕,此时北京时间为17时
 B.此季节当地昼长夜短
B.此季节当地昼长夜短
C.地球公转速度正逐渐减慢
D.当地正盛行东北风
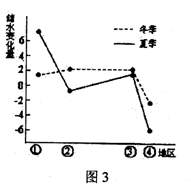
某地储水变化量为该地水量收入与支出之差。图3
读图1,回答1-2题。
1.图中洋流叙述正确的是 ( )
A.①为暖流②为寒流
B.①向北流②向南流
C.①为补偿流②为风海流
D.受洋流影响①处形成世界著名的渔场
2.关于图中洋流对地理环境的影响,正确的是( )
A.甲处气候形成的决定性因素是洋流
B.受洋流①影响甲处气候类型呈狭长状分布
C.洋流②对乙处有增温增湿的作用
D.受洋流②影响,乙处气候冬暖夏凉
 2009年12月17-19日,联合国气候变化会议在
2009年12月17-19日,联合国气候变化会议在
33.(8分)非洲某草原生态系统有如下图所示的食物网,请据图回答:
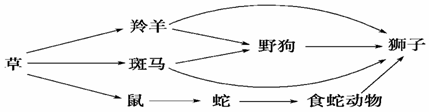
(1)这个食物网包括 条食物链。
(2)狮子在这个食物网中占据哪几个营养级 ,狮子和野狗的关系是 。
(3)当这个草原生态系统处于平衡状态时,输入系统的能量 输出系统的能量
(4)除以上生物外要使生态系统完整,还需要增加的成分是 和 。
(5)生态系统中在物质循环的过程中,同时伴随着 。若生产者有10000 KJ的能量,按能量最大传递效率计算,狮子最多可获得 KJ。
32.(12分)某同学进行实验,甲图为实验开始状态,乙图为实验结束状态。请在乙图所示实验结果的基础上继续实验,探究蔗糖的水解产物能否通过半透膜。
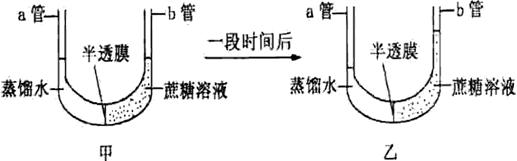
可选用的实验材料:蔗糖酶溶液、斐林试剂、试管、滴管、水浴锅等。
(1)设计出继续实验的简要步骤:
① ;
② 。
(2)预测实验现象并作出结论。
①若现象为 结论 ;
②若现象为 结论 。
31.(12分)在三叶草中有两个品种,叶片内含氰(HCN)的和不含氰的。现已查明,三叶草叶片内的氰化物是经下图生化途径产生的:基因D、R分别决定产氰糖苷酶和氰酸酶的合成,d、r无此功能,两对基因位于两对同源染色体上。
现有两个不产氰的品种杂交,F1全部产氰,F1自交得F2,F2中有产氰的,也有不产氰的。将F2各表现型的叶片提取液作实验,实验时在提取液中分别加入含氰糖苷酶和氰酸酶,然后观察产氰的情况,结果记录于下表:

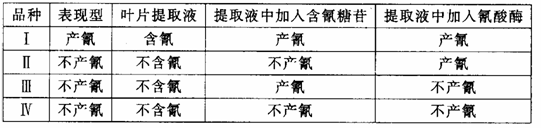 (1)亲本中两个不产氰品种的基因型是
,在F2中产氰和不产氰的理论比为
.出现这个比值是
的结果。
(1)亲本中两个不产氰品种的基因型是
,在F2中产氰和不产氰的理论比为
.出现这个比值是
的结果。
(2)品种Ⅱ不产氰是因为叶片中缺乏________酶,品种Ⅲ可能的基因型是_________。向品种Ⅳ的叶片提取液加入____________后该提取液可产生氰。
30.(10分)下图中甲、乙、丙分别表示几种环境因素对小麦光合作用强度的影响,除各图中所示因素外,其他因素均控制在小麦生长的适宜范围。请据图回答以下问题:
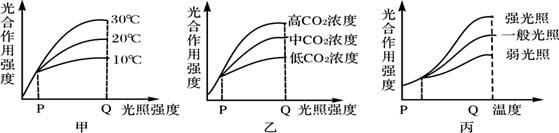
(1)甲图P点,限制小麦光合作用强度的因素为________;乙图Q点,高CO2浓度条件下,若要进一步提高光合作用强度,应注意满足植物生活的___________条件(请依据上述三图作答)。预计丙图Q点之后3条曲线的变化趋势为__________ 原因是 ______ _________。
(2)夏天中午光照强烈时,小麦光合作用强度低的主要原因可以用______图来说明,其具体解释为________________________________________________。
(3)合理施肥和合理灌溉可使小麦产量提高,这说明影响小麦光合作用强度的因素还有_________和____________。
(4)甲图中P点小麦叶肉细胞产生ATP的细胞器是________________。Q点叶片经脱色后,用碘液染色,呈蓝色的是________________细胞。
29.某芳香烃A有如下转化关系:
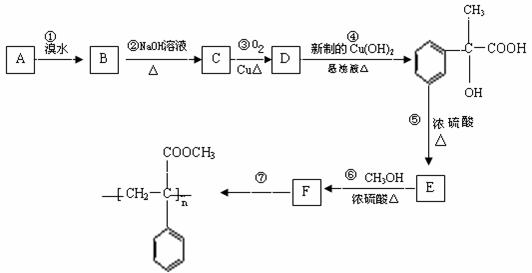
⑴.反应②和⑤的类型:②属于 反应;⑤属于 反应;
⑵.A、F结构简式:A ;F ;
⑶.反应③、⑤的化学方程式:
③ ;
⑤ ;
⑷.D还可以和新制的银氨溶液反应,化学反应方程式为:
。
28.物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。有的反应中反应物和生成物未全部给出,反应条件也未注明。
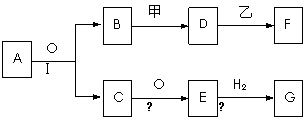
1)若A为硫酸工业的重要原料,C能使品红褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成,A和乙含一种相同的元素。则
①A的的化学式为 ,工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
②其中D→F的化学方程式为
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①写出B和甲反应的化学方程式_______________________。
②写出D溶液与乙反应的离子方程式
③E→G的化学方程式: ________________________________________。
(3)若27g 乙单质在足量的氧气中灼烧,反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: .
26.食盐是日常生活的必需品,也是重要的化工原料。
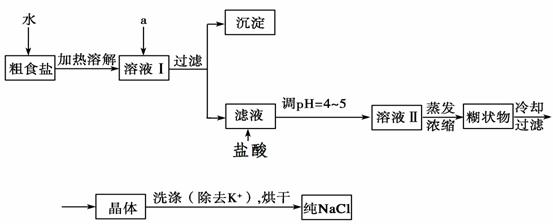 (1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO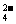 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、 Ba(NO3)2溶液、 欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO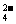 离子,选出a所代表的试剂,按滴加顺序依次为
、
、
。(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为
、
、
。(只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
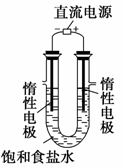 (3)电解饱和食盐水的装置如右图所示,若收集的H2为2 L,
(3)电解饱和食盐水的装置如右图所示,若收集的H2为2 L,
则同样条件下收集的Cl2 (填“>” “=”或“<”)
2 L,原因是 。
 装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH
的浓度,常用的方法为 。
(4)实验室制备H2和Cl2通常采用下列反应:
 Zn+H2SO4 ZnSO4+H2↑
Zn+H2SO4 ZnSO4+H2↑
 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
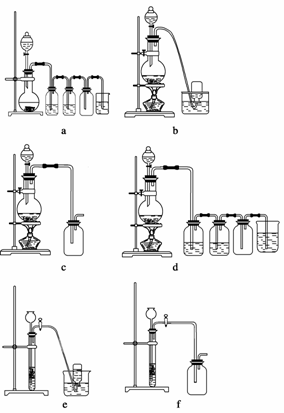 可选用制备气体的装置:
可选用制备气体的装置:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com