
2.阿伏加德罗定律的相关推论
①同温同压下气体体积比等于其 物质的量比
②同温同压下气体的密度比等于其 摩尔质量比
③同温同体积时,气体的压强比等于其物质的量比,等于 体积比
必须指出的是:无论是阿伏加德罗定律还是它的推论,均只适用于气体物质。
 V气体(标准状态)(L)
V气体(标准状态)(L)


 粒子数(N)
物质的量(n)
物质的质量(g)
粒子数(N)
物质的量(n)
物质的质量(g)
V溶液(L)
请你将上述关系图的转化方法标出来。w.w.w.k.s.5.u
1.定律:同温、同压下,相同体积的任何气体都含有相同数目的分子。
5. 溶液的稀释
⑴溶液的稀释:
①V1p1×W1%= V2p2×W2% 或W液×W1%=(W液+W水)×W2%(溶质的质量守恒)
②C1V1=C2V2(溶质的物质的量守恒)
⑵溶液混合:C V=C2V2+C1V1(溶质的质量守恒)

4.c、ω、ρ之间的计算关系
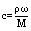 (cmol/L、ω、ρg/mL时,
(cmol/L、ω、ρg/mL时,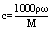 )
)
3.物质的量浓度的计算
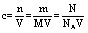
2.V、n、Vm之间的计算关系
⑴计算关系: n=V/Vm 。
⑵使用范围:
①适用于所有的气体,无论是纯净气体还是混合气体。
②当气体摩尔体积用22.4L·mol-1时必须是标准状况。
1. m、n、M之间的计算关系
⑴计算关系: n=m/M 。
⑵使用范围:只要物质的组成不变,无论是何状态都可以使用。
7. 物质的量浓度溶液的配制
⑴容量瓶
①特点:容量瓶上标有温度、容量和标线
②用途: 配制一定体积,一定物质的量浓度的溶液
容量瓶有各种不同规格,
常用的规格有100mL、250mL、500mL和1000mL等。
⑵配制一定体积物质的量浓度溶液的步骤及所用仪器如下:
 量筒、托盘天平(砝码)、烧杯 玻璃棒、胶头滴管、容量瓶
量筒、托盘天平(砝码)、烧杯 玻璃棒、胶头滴管、容量瓶
6. 物质的量浓度
⑴概念:以单位体积的溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度
⑵符号: C
⑶单位:mol.l-1
⑷说明:①物质的量浓度是溶液的体积浓度
②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种离子或分子。
5. 气体摩尔体积
⑴概念:单位物质的量的气体所占的体积
⑵符号:Vm
⑶单位:L.mol-1 。
⑷标准状况下的气体摩尔体积
①标准状况是指: 温度 0 ℃,压强 101 KPa。
②标准状况下的气体摩尔体积是: 22.4L.mol-1 。
⑸影响物质体积大小的因素:
①粒子的数目
②粒子的大小
③粒子间的距离
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com