
1.分子内各原子及共价键的空间排布对称,分子内正、负电荷中心重合的分子为非极性分子;分子内各原子及共价键的空间排布不对称,分子内正、负电荷中心不重合的分子为非极性分子。常见分子中,属非极性分子的不多,具体有:
①非金属单质分子。如:稀有气体、H2、Cl2、N2 等。
②结构对称的直线型分子。如:CO2
③结构对称的正三角形分子。如:BF3、BCl3
④结构对称的正四面体型分子。如:CH4、CCl4、P4
而其它大多数分子则为极性分子。如:HCl、H2O、NH3、CH3Cl等等。
2.共价键的类型
|
|
非极性键 |
极性键 |
|
概念 |
同种元素原子形成的共价键,共用电子对没有发生偏移 |
不同种元素原子形成的共价键,共用电子对发生偏移 |
|
原子吸引电子能力 |
相同 |
不同 |
|
共用电子对 |
不偏向任何一方 |
偏向吸引电子能力强的原子 |
|
成键原子电性 |
电中性 |
显电性 |
|
形成条件 |
由同种非金属元素组成 |
由不同种非金属元素组成 |
|
特别提醒: 极性共价键参与形成化合价,非极性共价键不参与形成化合价。共价化合物中,假设共用电子全部转移到非金属性相对强的一方原子后,成键原子所“得”或所“失”的电子数就是该元素的合化价。如:H2O2,Na2O2中O为-1价,FeS2中的S为-1价。 |
[例1](2008·梅州模拟)下列物质中,含有非极性共价键的离子化合物的是 ( )
A.NH4NO3 B.Cl2 C.H2O2 D.Na2O2
[解析]NH4NO3是含有极性共价键离子化合物,故A不正确;Cl2属于单质,不是化合物,故B不正确;H2O2中虽然含有非极性共价键,但它是离子化合物,故C不正确;Na2O2虽然是离子化合物,但其O22- 内部含有极性共价键([O-O]2-),故D正确。
[答案]D
考点2 极性分子与非极性分子
根据共价分子中电荷分布是否对称,正负电荷重心是否重合,整个分子电性是否出现“两极”,把分子分为极性分子和非极性分子。
1.化学键的类型
|
化学键 类型 |
离子键 |
共价键 |
金属键 |
|
概念 |
阴阳离子间通过静电引力作用所形成的化学键 |
原子间通过共用电子对所形成的化学键 |
金属阳离子与自由电子间通过相互作用而形成的化学键 |
|
成键微粒 |
阴阳离子 |
原子 |
金属阳离子和自由电子 |
|
成键性质 |
静电作用 |
共用电子对 |
电性作用 |
|
形成条件 |
活泼金属与活泼的非金属元素 |
非金属与非金属元素 |
金属内部 |
|
实例 |
NaCl、MgO |
HCl、H2SO4 |
Fe、Mg |
|
特别提醒: 1.离子键一般由活泼的金属元素和不活泼的非金属元素组成,或者由铵根离子和不活泼的非金属元素组成;共价键一般由非金属元素组成;而金属键则存在于金属单质内部。 2.离子三特征: 离子所带的电荷:阳离子电荷就是相应原子失去的电子数;阴离子电荷是相应原子得到的电子数。 离子的电子构型:主族元素形成的简单离子其电子层结构与在周期表中离它最近的惰性气体原子结构相同。 离子的半径:离子半径大小近似反映了离子的大小。一般来说,电子层数相同的离子,随着核电荷数的增大,离子半径减小。 3.共价键三参数 键能:折开1mol共价键所吸收的能量(KJ/mol)。键能越大,键越牢固,含该键的分子越稳定。 键长:两个成键原子核间的(平均)距离。键长越短,键能越大,键越牢固,含该键的分子越稳定。 键角:分子中两个键轴间的夹角。它决定了分子的空间构型。 |
2.根据元素的单质及其化合物的性质进行判断。
(1)金属性强弱判断原则
①根据单质与水(或酸)反应,置换出水(或酸)中的氢的难易程度来判断:
一般地,能与水反应产生氢气的金属元素的金属性比不能与水反应的金属元素的强,与冷水反应产生氢气的金属元素的金属性比只能与热水反应产生氢气的金属元素的强。
②根据元素的最高价氧化物对应的水化物的碱性强弱来判断:
一般地,元素的最高价氧化物对应的水化物的碱性越强,则对应的金属元素的金属性就越强。反之,则越弱。
③根据置换反应进行的方向来判断:一般是“强”置换“弱”。
④根据金属元素的单质的还原性(或离子的氧化性)来判断:
一般情况下,金属阳离子的氧化性越强,则对应的金属单质的还原性越弱,金属元素的金属性也就越弱。
⑤根据原电池的正、负极及金属腐蚀的难易程度来判断:一般地,负极为金属性强的元素的单质,容易腐蚀。
(2)非金属性强弱判断原则
①根据单质与H2反应生成气态氢化物的剧烈程度或生成的气态氢化物的稳定性强弱来判断:
一般地,单质与H2反应生成气态氢化物越容易,或反应生成的气态氢化物越稳定,则对应的非金属元素的非金属性越强;反之,则越弱。
②根据元素最高价氧化物对应的水化物的酸性强弱来判断:
一般地,元素的最高价氧化物对应的水化物的酸性越强,则对应的非金属元素的非金属性就越强。反之,则越弱。
③根据置换反应进行的方向来判断:一般是“强”置换“弱”。
④根据非金属单质的氧化性(或离子的还原性)强弱来判断:
一般情况下,非金属阴离子的还原性越强,则对应的非金属单质的氧化性越弱,非金属性元素的非金属性也就越弱。
⑤根据与同一种金属反应,生成化合物中金属元素的化合价的高低进行判断。例如: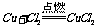 ,2Cu+S=Cu2S,即得非金属性:Cl2>S。
,2Cu+S=Cu2S,即得非金属性:Cl2>S。
特别提醒
一般来说在氧化还原反应中,单质的氧化性越强(或离子的还原性越弱),则元素的非金属性越强;单质的还原性越强(或离子的氧化性越弱),则元素的金属性越强。故元素的金属性和非金属性的强弱判断方法与单质的氧化性和还原性的强弱判断方法是相一致的。
[例3](2008·北京)下列叙述正确的是( )
A.IA族元素的金属性比IIA族元素的金属性强
B.VIA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增加
D.第三周期元素的离子半径从左到右逐渐减小
[解析]本题考查元素周期律,元素性质的递变,同一周期IA族元素的金属性比IIA族元素的金属性强,但不同周期不能确定;氢化物的沸点还要考虑氢键;同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增加;第三周期元素的阴、阳离子半径从左到右逐渐减小,但阳离子半径大于阴离子半径,故选B。
[答案]B
考点4 元素“位-构-性”之间的关系
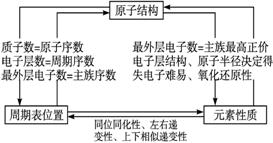
特别提醒:元素性质和物质结构的常用的突破口
(1)形成化合物种类最多的元素是碳。
(2)某元素的最高价氧化物的水化物能与其气态氢化物化合生成盐,该元素是氮。
(3)在地壳中含量最多的元素是氧,在地壳中含量最多的金属元素是铝。
(4)常温下呈液态的非金属单质是溴,金属单质是汞。
(5)气态氢化物最稳定的元素是氟。
(6)三种元素最高氧化物对应的水化物两两皆能反应,则必定含有Al元素。
(7)焰色反应呈黄色的元素是钠,焰色反应呈紫色的元素是钾。
(8)最高价氧化物对应水化物酸性最强的元素是氯。
(9)单质的硬度最大的元素是碳。
(10)化学式为A2B2形的化合物,则只可能为Na2O2、H2O2、C2H2。
[例4](2007·江苏)有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
[解析]由题目推知,X位于Y的上方,是属于同主族元素,所以当X(OH)n为强碱,则Y(OH)n也一定为强碱,A正确。若X为N,则NH3显碱性,B不正确。若X为H,则C错误。若Y为Cl,则X为F,而F是通常是没有正价。
[答案]A
1.根据元素周期表的知识进行判断
①同一周期,从左到右,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。元素周期表中最活泼的金属是Fr,天然存在的最活泼的金属是Cs;最活泼的非金属元素是F。
②同一主族,从上到下,随着原子序数的递增,元素的金属性逐渐增强,非金属性逐渐减弱。元素周期表左边为活泼的金属元素,右边为活泼的非金属元素;中间的第VIA、VA族则是从非金属元素过渡到金属元素的完整的族,它们的同族相似性甚少,但具有十分明显的递变性。
3.18电子的微粒:2.(1)
(1)分子: Ar、SiH4、PH3、H2S、HCl、CH3CH3、N2H4、H2O2、F2、CH3OH、CH3F 等;
(2)离子: S2-、Cl-、K+、Ca2+、HS- 。
[特别提醒]:
记忆10电子微粒的方法:首先找出10电子的原子(单原子分子)Ne,然后向前寻找非金属元素对应的氢化物:CH4-HF,向后寻找金属形成的阳离子:Na+-Al3+。在氢化物的基础上增加或减少H+,可构成一系列的离子。
记忆18电子的微粒方法:首先找出18电子的原子(单原子分子)Ar,然后向前寻找非金属元素对应的氢化物:SiH4-HCl,向后寻找金属形成的阳离子:K+-Ca2+。在氢化物的基础上减少H+,可构成一系列的离子。还有部分18电子的分子可通过10电子的氢化物分析得到,10电子的氢化物分子去掉一个H得到9电子的基团:-CH3、-NH2、-OH、-F,这些基团两两结合可形成18电子的分子。
[例5]下列化合物中阴离子半径和阳离子半径之比最大的是( )
A.LiI B.NaBr C.KCl D.CsF
[解析]离子的电子层数越多,半径越大,卤族离子中,I-的电子层最多,故半径最大,而碱金属中,Li+半径最小。
[答案]A
2.10电子的微粒:
(1)分子: Ne、CH4、NH3、H2O、HF ;
(2)离子: Na+、Mg2+、Al3+、NH4+、NH2-、H3O+、OH-、O2-、F- 。
1.原子半径和离子半径
|
原 子 半 径 |
1.电子层数相同时(同周期元素),随原子序数递增,原子半径减小 例:Na>Mg>Al>Si>P>S>Cl 2.最外层电子数相同时(同主族元素),随电子层数递增原子半径增大。 例:Li<Na<K<Rb<Cs |
|
离 子 半 径 |
1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例:Cl―>Cl,Fe>Fe2+>Fe3+ 2.电子层结构相同的离子,核电荷数越大,半径越小。例:O2―>F―>Na+>Mg2+>Al3+ 3.带相同电荷的离子(同主族元素的离子),电子层越多,半径越大。 例:Li+<Na+<K+<Rb+<Cs+;O2―<S2―<Se2― 4.带电荷、电子层均不同的离子可选一种离子参照比较。 例:比较K+与Mg2+可选Na+或Ca2+为参照可知K+>Na+(或Ca2+)>Mg2+ |
2、三个基本关系
(1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中)
(2)电性关系:
①原子中:质子数=核电荷数=核外电子数
②阳离子中:质子数>核外电子数 或 质子数=核外电子数+电荷数
③阴离子中:质子数<核外电子数 或 质子数=核外电子数-电荷数
(3)质量关系:质量数 = 质子数 + 中子数
|
[特别提醒] 对于公式:质量数(A)=质子数(Z)+中子数(N),无论原子还是离子,该公式均适应。 原子可用 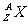 表示,质量数A写在原子的右上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。原子周围右上角以及右下角或上面均可出现标注,注意不同位置标注的含义,右上角为离子的电性和电荷数,写作n 表示,质量数A写在原子的右上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。原子周围右上角以及右下角或上面均可出现标注,注意不同位置标注的含义,右上角为离子的电性和电荷数,写作n ;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作 ;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作 n形式,注意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子,可写作 n形式,注意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子,可写作 O O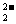 。 。 |
[例1](2008·茂名一模)一定量的锎(98252Cf)是有用的中子源,1mg(98252Cf)每秒约放出2. 34xl99个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是( )
A.98252Cf原子中,中子数为154 B.98252Cf原子中,质子数为98
C.98252Cf原子中,电子数为 98 D.锎元素的相对原子质量为252
[解析]98252Cf原子核外有98个电子,核内有98个质子,154个中子,质量数为252。
[答案]D
[规律总结]抓住公式质量数(A)=质子数(Z)+中子数(N),可迅速解决原子和离子中质子数和中子数的关系。
考点2 原子核外电子排布规律
|
核 外 电 子 排 布 规 律 |
1 |
各电子层最多能容纳 2n2
个电子 即:电子层序号 1 2 3 4 5 6 7 代表符号 K L M N O P Q 最多电子数 2 8 18 32 50 72 98 |
|
2 |
最外层电子数目不超过 8 个(K层为最外层时不超过2个)。 |
|
|
3 |
次外层电子数最多不超过 18
个,倒数第三层不超过
32 个。 |
|
|
4 |
核外电子总是尽先排满能量最低、离核最近的电子层,然后才由里往外,依次排在能量较高,离核较远的电子层。 |
|
|
注意 事项 |
1.以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。 2.上述乃核外电子排布的初步知识,只能解释1-18号元素的结构问题,若要解释更多问题,有待进一步学习核外电子排布所遵循的其它规律。 |
|
[特别提醒]1-18号元素的原子结构特性: ①原子核中无中子的原子:11H。 ②最外层有1个电子的元素:H、Li、Na。 ③最外层有2个电子的元素:Be、Mg、He。 ④最外层电子数等于次外层电子数的元素:Be、Ar。 ⑤最外层电子数是次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne。 ⑥电子层数与最外层电子数相等的元素:H、Be、Al。 ⑦电子总数为最外层电子数2倍的元素:Be。 ⑧次外层电子数是最外层电子数2倍的元素:Si。 ⑨内层电子数是最外层电子数2倍的元素:Li、P。 |
[例2](2008·广州二模·理基)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层上只有一个电子,下列说法正确的是( )
A.X可能是第二周期的非金属元素 B.X可能是第三周期的金属元素
C.Y可能与X同主族 D.Y一定是金属元素
[解析]根据题意,因“X原子的最外层电子数是次外层电子数的一半”,故X可能为Li或Si,又“Y位于X的前一周期,且最外层上只有一个电子”,故若X为Li,则Y为H;若X为Si,则Y为Li 。
[答案]C
考点3 相对原子质量
 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为1,符号为1(单位1一般不写)
定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为1,符号为1(单位1一般不写)
 原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。
原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。
如:一个氯原子的m(35Cl)=5.81×10-26kg。
核素的相对原子质量:各核素的质量与12C的质量的1/12的比值。一种元素有几种同位素,就应有几种不同的核素的相对原子质量,
相对 诸量 如35Cl为34.969,37Cl为36.966。
原子 比较 核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该质量 核素的质量数相等。如:35Cl为35,37Cl为37。
元素的相对原子质量:是按该元素各种天然同位素原子所占的原子个数百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a% + Ar(37Cl)×b%
元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其原子个数百分比的乘积之和。
 注意 ①、核素相对原子质量不是元素的相对原子质量。
注意 ①、核素相对原子质量不是元素的相对原子质量。
②、通常可以用元素近似相对原子质量代替元素相对原子质量进行必要的计算。
[例4](2008·汕头二模)某元素一种同位素的原子的质子数为m,中子数为n,则下列说法正确的是( )
A.不能由此确定该元素的原子量
B.这种元素的原子量为(m+n)
C.若碳原子质量为w g,此原子的质量为(m+n)w g
D.核内中子的总质量小于质子的总质量
[解析]元素的相对原子质量是各同位素相对原子质量的平均值,所以A正确,B不正确。由相对原子质量的概念,若设该核素一个原子的质量为x,并且我们用该核素的质量数代替核素的相对原子质量时,方有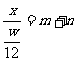 ,即x=
,即x=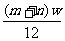 ,C不正确。在原子核内,一个中子的质量比一个质子的质量略大,但核内的质子数和中子数无法确定,因此D不正确。
,C不正确。在原子核内,一个中子的质量比一个质子的质量略大,但核内的质子数和中子数无法确定,因此D不正确。
[答案]A
[规律总结]分清相对原子质量、质量数的有关概念,切不可用核素的相对原子质量代替元素的相对原子质量。
考点4 微粒半径的大小比较和10电子、18电子微粒
22.自然灾害对经济和社会发展的影响,越来越引起人们的重视,防灾、减灾已成为人们研究的主要课题。读下图回答问题:
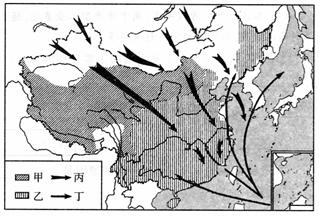 (1)甲为我国
能源丰富区;乙为我国某时期平均降水pH<5.6的地区,防治该问题的根本途径是
。
(1)甲为我国
能源丰富区;乙为我国某时期平均降水pH<5.6的地区,防治该问题的根本途径是
。
(2)甲、乙分布区几乎不重叠,说明了两地区自然和社会环境有很大的不同,即( )。
A.降水量悬殊较大 B.工矿、人口分布稠稀明显
C.热量条件差异大 D.地质灾害发生频率大小不同
(3)简述丁气象灾害造成的主要危害及减轻该种气象灾害的重要措施。
(4)图中丙气象灾害名称是 ,发生在 季,对农作物危害最大。请简述该气象灾害对西藏和云贵高原影响较小,不易侵入四川盆地、广东、海南、台湾等地的原因。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com