
12.读下面这首诗,完成(1)-(3)题。(10分)
临高台
萧衍①
高台半行云。望望高不极。草树无参差。山河同一色。
仿佛洛阳道。道远难别识。玉阶故情人。情来共相忆。
临 高 台
沈约②
高台不可望,望远使人愁。连山无断绝,河水复悠悠。
所思竟何在?洛阳南陌头。可望不可见,何用解人忧?
[注]①萧衍:梁武帝。在位四十八年,年八十六。有集三十二卷。
②沈约:南朝吴兴武康(今浙江德济县西)人,与萧衍同属“意陵八友”。
(1)下面对诗句的理解,不正确的两项是(4分)
A.萧衍沈约二人同登一座高台,采用同一视角观望,同怀念远在洛阳的情人,诗中都有借景抒情的妙笔。
B.萧诗中,作者登高怀远,思念之切竟使眼前的丛莽幻化出一条通往洛阳的道路,延伸到远方的情人身边。
C.玉阶通常是古代淑女伫立凝望之所,萧衍用玉阶来暗示自己期望故情人同样满怀思念,为下文“共相忆”埋下了巧妙的伏笔。
D.两首诗的开头都用“望”字,但两人诗中的“望”字却不同解:萧诗中“望”字做仰望解,沈诗中“望”字却做远望解。
E.两首诗的结尾都采用了直抒胸臆的手法,表达对情人的相思,这增强了诗歌情感的感染力、也增加了诗歌的穿透力。
(2)同为登高怀人,两首诗歌的情感却有一定的差别。请你结合诗句谈一谈。(3分)
(3)萧衍诗的前两句如何表现高台之“高”的?请从作品语言或者修辞方法中任选一角度,具体说明。(3分)
11.将下面文言文中画线的部分用斜线断句。(5分)
西循崖可二里,连石若重楼,翼乎临于溪右。①石罅生大树荫数十人前出平土,可布席坐。
②南有泉明何文端公摩崖书其上曰媚笔之泉。泉漫石上,为圆池,乃引坠溪内。左丈学冲于池侧方平地为室,未就,要客九人饮于是。③日暮半阴山风卒起,肃振岩壁,榛莽、群泉、矶石交鸣。游者悚焉,遂还。
(取材自清姚鼐《游媚笔泉记》)
5.下列句子中,有语病的一句是 ( )
A.只能接受掌声和鲜花、一遇到反对意见就暴跳如雷的人,是不成熟的;真正成熟的人,会冷静睿智地对待各种不同的意见。
B.面对和平而不太平的价值多元化的世界,国与国的主要竞争方式从残酷的军事对抗转向经济、社会、文化综合能力的比拼。
C.在国外,围绕《魔戒》《哈利·波特》《纳尼亚传奇》《金刚》等小说进行的边缘产品开发,已经渗透到人们文化生活的多个层面。
D.千万考生所命运攸关的高考作文不再有意回避社会热点,引导考生关注他人,关注社会、关注自我与外部世界之间的联系。
4.下列句子中,加点的成语或熟语使用不恰当的一项是 ( )
A.人生短暂,如白驹过隙,让美丽的青春放射出最夺目的光彩,我们的生命才更有意义。
B.魔术的魅力在于它能营造出让人百思不得其解的神秘感,给观众带来一种奇特的享受。
C.如果不能解决资金不足、剧本单一等问题,一度火爆的小剧场话剧难免遭遇“倒春寒”。
D.合唱队获得全市一等奖的喜讯传来,全校同学欢呼雀跃,一片哗然,沉浸在欢乐的气氛中。
3.依次填入下面横线处的词语,恰当的一组是 ( )
①老舍先生虽然获得过1968年的诺贝尔文学奖 ,却由于种种原因没有获奖,这不能不说是国人的一大遗憾。
②当今社会报刊、广播、电视、互联网、手机WAP平台越来越及时、越来越立体化地为人们提供着各种 。
③这个年轻人虽然工作时间不长,但工作能力强,对自己要求严,深得老领导们的 ,很快就独当一面了。
A.题名 资信 尊重 B.提名 资讯 器重
C.提名 资信 尊重 D.题名 资讯 器重
2.下列各组词语,没有错别字的一组是 ( )
A.刚健 抄近路 甘拜下风 大快朵颐
B.脉搏 大拇指 出奇不意 不记其数
C.凋蔽 口头禅 蛛丝蚂迹 如愿以偿
D.按装 拌脚石 吉人天相 平添烦恼
1.下列词语中,字形和加点的字的读音全都正确的一项是 ( )
痕迹 结束 挫折 影片 档案
A.jī sù cuò piàn dàng
B.jì sǔ cuō piàn dǎng
C.jī shù cuò piàn dàng
D.jī shù cuō piān dǎng
44.



 (09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
 (1)在ClO2的制备方法中,有下列两种制备方法:
(1)在ClO2的制备方法中,有下列两种制备方法:
 方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
 方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
 (2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
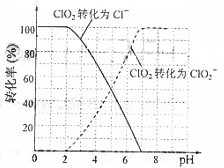
 饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-

 完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
 ① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
 ②请完成相应的实验步骤:
②请完成相应的实验步骤:
 步骤1:准确量取VmL水样加入到锥形瓶中。
步骤1:准确量取VmL水样加入到锥形瓶中。
 步骤2:调节水样的pH为7.0~8.0
步骤2:调节水样的pH为7.0~8.0
 步骤3:加入足量的KI晶体。
步骤3:加入足量的KI晶体。
 步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
 步骤5: 。
步骤5: 。
 步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
 ③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
 ④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
 答案:
答案:
(1)方法二制备的ClO2中不含Cl2
 (2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
(2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
 ②调节溶液的pH≤2.0
②调节溶液的pH≤2.0
 ③
③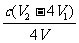
 ④Fe(OH)3
④Fe(OH)3

 解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I-
解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I- 完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0
完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0 。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案
。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案

 [考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
[考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
45 .(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
.(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

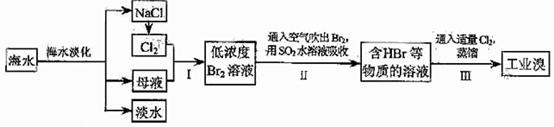
 (1)请列举海水淡化的两种方法: 、 。
(1)请列举海水淡化的两种方法: 、 。
 (2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
 (3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
 (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
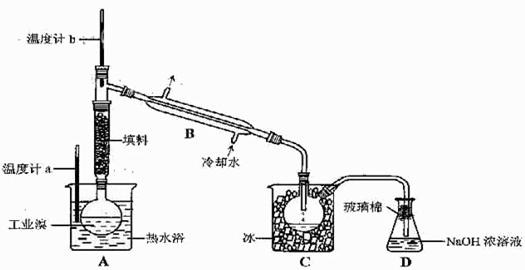
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:

 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器B的名称:
。
①图中仪器B的名称:
。
 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
 ④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
解析:本题考查海水中提取溴的实验。电解NaCl溶液的方程式为:2NaCl
+ 2H2O 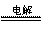 2NaOH+H2↑+Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
2NaOH+H2↑+Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
43. (09年海南化学·20.4)(11分)
(09年海南化学·20.4)(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
答案:(11分)
(1)4NH3+5O2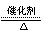 4NO+6H2O
4NO+6H2O (3分)
(3分)
 (2)提高氨的转化率和一氧化氮的转化率(2分)
(2)提高氨的转化率和一氧化氮的转化率(2分)
 (3)增大单位质量的催化剂与反应物的接触面积(2分)
(3)增大单位质量的催化剂与反应物的接触面积(2分)
 (4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
(4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
解析:(1)
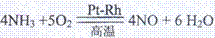
(2)根据平衡原理,增大反应物的浓度,平衡向正反应方向移动,以提高原料的转化率;
(3)这是为了增大铂铑合金的表面积,使接触面积增大,提升催化的效果;
(4)为了提高吸收率,可根据溶解过程放热采用降温处理,且气体的吸收可用加压的方式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com