
8.已知数列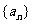 中,
中,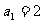 ,前
,前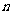 项和
项和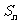 ,若
,若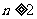 时,
时,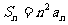 ,求
,求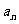
7、在数列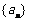 中,已知
中,已知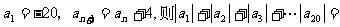 ______.
______.
6、已知数列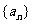 前
前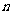 项和
项和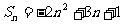 ,则
,则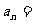 __________.
__________.
3、设a1=1,an+1=an+,则an=_________________.
4已知数列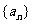 满足
满足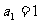 ,
,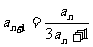 ,则
,则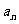 =_______
=_______
5数列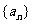 中,
中,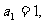 对所有的
对所有的 都有
都有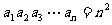 ,则
,则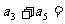 __________.
__________.
2. (05湖南卷)设f0(x)=sinx,f1(x)=f0′(x),f2(x)=f1′(x),…,fn+1(x)=fn′(x),n∈N,则f2005(x)=
A.sinx B.-sinx C.cosx D.-cosx
1. (05湖南卷)已知数列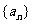 满足
满足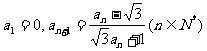 ,则
,则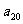 =
=
A.0 B.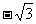 C.
C.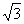 D.
D.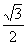
2、碱:电离时生成的阴离子全部是氢氧根离子的化合物
1、酸:电离时生成的阳离子全部是氢离子的化合物
与其它平衡相同,弱电解质在中达到电离平衡时电离程度的大小主要由电解质本身的性质决定,同时受到外界条件的影响。电离过程的热效应较小,在温度变化不大的情况下,一般不考虑温度对电离平衡的影响。若温度升高较多时,电离程度增强,离子浓度增大。
在一定温度下,稀释溶液,弱电解质电离程度增强,离子数目增多,但由于溶液体积增大而离子浓度降低。当加入含有弱电解质组成的相同的离子时,弱电解质的电离平衡向左移动。
对CH3COOH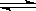 H++CH3COO-的电离平衡,小结如下:
H++CH3COO-的电离平衡,小结如下:
|
条件变化 |
平衡移动 |
电离度 |
K |
离子数目 |
离子浓度 |
|
加热 |
正向移动 |
增大 |
增大 |
增多 |
增大 |
|
稀释 |
正向移动 |
增大 |
不变 |
增多 |
减小 |
|
加冰醋酸 |
正向移动 |
减小 |
不变 |
增多 |
增大 |
|
加盐酸 |
逆向移动 |
减小 |
不变 |
H+ 增多 CH3COO-减少 |
|
|
加醋酸钠 |
逆向移动 |
减小 |
不变 |
H+ 减少 CH3COO-增多 |
例1:在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答:

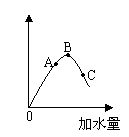 (1)“O”点导电能力为“0”的理由是
(1)“O”点导电能力为“0”的理由是
___________ ______。
(2)A、B、C三点pH值由大到小的顺序是
_______________________。
(3)A、B、C三点电离程度最大的是____________
解析:溶液的导电能力取决于离子浓度的大小,C点离子浓度最小,
加水量最多,电离程度最大。
答案(1)“O”点时醋酸尚未电离; (2)C>A>B(3)C
30. 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶出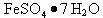 。
。
II将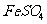 溶液与稍过量的
溶液与稍过量的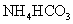 溶液混合,得到含
溶液混合,得到含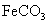 的浊液
的浊液
IV 将浊液过滤,用90。C热水洗涤沉淀,干燥后得到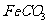 固体
固体
V煅烧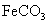 ,得到Fe2O3固体
,得到Fe2O3固体
已知: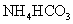 在热水中分解
在热水中分解
(1)
I中,加足量的铁屑除去废液中的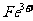 ,该反应的离子方程式是
,该反应的离子方程式是
(2)
II中,生成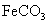 的离子方程式是
。若
的离子方程式是
。若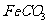 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(3)
IV中,通过检验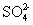 来判断沉淀是否洗涤干净。此操作是
来判断沉淀是否洗涤干净。此操作是
(4)
已知煅烧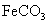 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的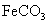 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有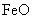 ,则该产品中Fe2O3的质量是
kg(摩尔质量/g·
,则该产品中Fe2O3的质量是
kg(摩尔质量/g·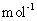 :
: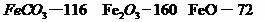 )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com