
1.离子反应:指在溶液中(或熔化状态下)有离子参加或离子生成的反应。
2.强电解质、弱电解质
|
|
强电解质 |
弱电解质 |
|
定义 |
在水溶液中能全部电离的电解质 |
在水溶液中只能部分电离的电解质 |
|
电离程度 |
完全 |
部分 |
|
电离平衡 |
不存在 |
存在 |
|
溶液中存在微粒种类 |
水合离子、水分子 |
水合离子、水分子 弱电解质分子 |
|
电离过程 |
不可逆、不存在电离平衡 |
可逆、存在电离平衡 |
|
相互关系 |
均为电解质。在相同条件下,强电解质溶液的导电能力强于弱电解质溶液 |
|
|
电离方程式 书写规律 |
用等号 HnA=nH++An- |
用可逆符号,弱酸分步电离 HnA
H+ +HA(n-1)- HnA
H+ +HA(n-1)-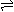 HA(n-1)- H+ +H2A(n-2)- HA(n-1)- H+ +H2A(n-2)- |
|
举例 |
强酸:HCl H2SO4 HNO3 HClO4 HBr HI 强碱:KOH NaOH Ba(OH)2等. 绝大部分盐:BaSO4 BaCl2. 等 |
弱酸:CH3COOH HCN H2S H2CO3等 弱碱:NH3H2O Cu(OH)2等. H2O及小部分盐:(CH3COO)2Pb等. |
[例1]下列物质属于电解质的是( )
A.Na2O B.SO3 C.Cu D.NaCl溶液
[解析] Na2O为离子化合物,在熔融条件下能导电,为电解质,故A正确;SO3为共价化合物,在熔融条件下不能导电,其水溶液能导电是SO3与水反应生成的H2SO4导电,故SO3为非电解质,B不正确;Cu是单质,NaCl溶液为混合物,它们既不是电解质,也不是非电解质,故C、D都不正确。
[答案]A
|
特别提醒: 1.电解质是指在水溶液中或熔融状态下能够导电的化合物。水溶液中或熔融状态下,这两者之间只需满足一者就行了,但必须强调的是其本身能够导电,而不是反应的生成物。如SO2、SO3的水溶液虽然能导电,但它们都不是电解质,原因是在溶液中真正起到导电作用的是它们与水反应的生成物H2SO3、H2SO4,而不是它们自己本身。Na2O的水溶液的导电虽然也是它与水反应生成的NaOH导电,但因为其在熔融状态下本身能够导电,所以Na2O是电解质。 2.电解质和非电解质都是化合物,单质它既不是电解质,也不是非电解质。 3.判断某电解质是强电解质还是弱电解质关键是看它在水溶液中电离时是完全电离还是部分电离,与其溶解度大小、导电能力强弱等因素无关。 |
考点二 离子方程式的书写
1.电解质、非电解质
|
|
电解质 |
非电解质 |
|
定义 |
在水溶液中或熔融状态下 能导电的化合物 |
在水溶液中和熔融状态下 均不能导电的化合物 |
|
本质 |
在水溶液中或熔融状态下 能够电离的化合物 |
在水溶液中和熔融状态下 均不能发生电离的化合物 |
|
导电实质 |
产生了自由移动的离子 |
没有产生自由移动的离子 |
|
结构特点 |
离子化合物和某些具有极性键 的共价化合物 |
某些共价化合物 |
|
共同点 |
均为化合物 |
|
|
注意点 |
电解质非、电解质的区分与化合物的水溶性无关. |
|
|
举例 |
NaCl Ba(OH)2
CH3COOH |
CH3CH2OH C12H22O11 |
2.配平步骤(以高锰酸钾和浓盐酸反应制氯气为例):
①标出化合价变化了的元素的化合价。如:
+7 -1 +4 0
KMnO4+HCl==KCl+MnCl2+Cl2↑+H2O
②根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成1︰1的关系。如:+7 -1 +4 0
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
③调整系数,使化合价升降总数相等。
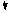
 化合价↓ 5×②
化合价↓ 5×②
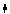


 KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
化合价↑2×⑤
④根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。如:2KMnO4+10HCl==KCl+2MnCl2+5Cl2↑+H2O
⑤利用元素守恒,用观察方法配平没有参加氧化还原反应的其他物质的系数。如:
2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O
⑥检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
[例3](2008·江西信丰中学)对于反应KMnO4+HCl→KCl+MnCl2+Cl2+H2O(未配平),若有0.1mol KMnO4参加反应,下列说法正确的是( )
A.其转移电子0.5mol B.生成Cl20.5mol
C.参加反应HCl为16mol D.Cl2是还原产物
[解析]配平该方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O ,Mn由+7→+2,得到5电子,则0.1mol KMnO4参加反应消耗HCl为1.6mol,转移的电子为0.5mol,生成的Cl2为0.25mol,故A正确,B、C不正确;Cl2是氧化产物,故D不正确。
[答案]A
考点四 电子转移守恒应用
电子转移守恒法是依据氧化剂与还原剂得失电子数目相等这一原则进行计算的。电子转移守恒法是氧化还原反应计算的最基本的方法。
[例4](2007·广州·学业水平测试)在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.l∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶2
[解析]用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半。
[答案]B
1.配平原则:电子守恒、原子守恒、电荷守恒
10.根据(氧化剂、还原剂)元素的价态进行判断:
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO34< HClO24< HClO。
注意:①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。
②原子的氧化性一般都强于分子的氧化性。如:氧化性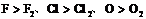 等。
等。
[例2](2007·聊城二模)常温下,在下列溶液中发生如下反应
①16H++10Z-+2XO4-=2x2++5Z2+8H2O ②2A2+ +B2=2A3++2B- ③2B-+Z2=B2+2Z- 由此判断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行。 B.Z元素在①③反应中均被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
[解析]根据上述规律4可得:氧化性顺序:XO4->Z2>B2>A3+,还原性顺序:A2+>B->Z->X2+。
[答案]B
考点三 氧化还原反应方程式的配平方法
9.根据元素在周期表中位置判断:
(1)对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
(2)对同主族的金属而言,从上到下其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强。
(3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱。
8.根据电解池中溶液里阴、阳离子在两极放电顺序来判断。
如:Cl-失去电子的能力强于OH-,还原性: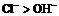 。
。
7.根据原电池的正负极来判断:
在原电池中,作负极的金属的还原性一般比作正极金属的还原性强。
6.根据被氧化或被还原的程度来判断:
如: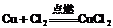 ,
,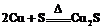 , 即氧化性:
, 即氧化性: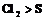 。
。
又如: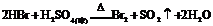 ,
,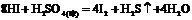 ,
,
即有还原性: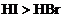 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com