
12.有一实验如图所示,将30mL0.1mol·L-1Ba(OH)2溶液置于烧杯中,然后边慢 慢加入0. 1mox/l某第三周期元素形成的某酸溶液共25ml.加入酸溶液的体积V与电流强度I的I-V图如下图所示。
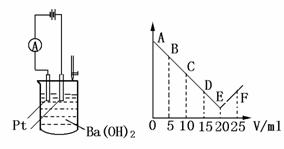 (1)此酸的化学式为
。
(1)此酸的化学式为
。
(2)处于C点时溶液中导电的阳离子主要是 。
(3)处于F点时,溶液中导电的阴离子主要是 。
(4)烧杯中刚加入酸时,观察到的现象是 。
(5)从A?E电流强度I变小的主要原因是 。
限时训练5 §3.1 电离平衡
11.甲、乙两瓶氨水的浓度分别1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中 c(OH-)之比 (填大于、等于或小于)10。请说明理由: 。
10.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而减小的是( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/(OH-)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
9.在RNH2·H2O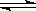 RNH3+ + OH-的平衡中,要使RNH2·H2O的电离平衡右移且c(OH-)增大,可采取的措施是( )
RNH3+ + OH-的平衡中,要使RNH2·H2O的电离平衡右移且c(OH-)增大,可采取的措施是( )
A.通入HCl B.加少量NaOH固体 C.加水 D.升温
8.将c(H+)=1×10-2mol·L-1的CH3COOH和HNO3溶液分别稀释100倍,稀释后两溶液的H+的物质的量浓度分别为a和b,则a和b的关系为( )
A.a>b B.a<b C.a=b D.不能确定
7.下列电离方程式书写正确的是( )
A.H2S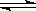 H++HS- HS-=H++S2- B.NaHCO3
=== Na++HCO3-
HCO-3 === H++CO32
-
H++HS- HS-=H++S2- B.NaHCO3
=== Na++HCO3-
HCO-3 === H++CO32
-
C.Na2HPO4=2Na++H++PO43- D.HF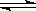 H++F-
H++F-
6.对某弱酸稀溶液加热时,下列叙述错误的是( )
A.弱酸的电离度增大 B.弱酸分子的浓度减小
C.溶液的c(OH-)增大 D.溶液的导电性增强
5.在平衡体系中:H2S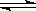 H++HS-,HS-
H++HS-,HS-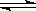 H++S2-,增大溶液的pH值时,则c(S2-)变化正确的是( )
H++S2-,增大溶液的pH值时,则c(S2-)变化正确的是( )
A.可能增大也可能减小 B.增大 C.减小 D.不变
4.把0.05molNaOH固体分别加入到100mL液体中,溶液的导电能力变化不大的是( )
A.自来水 B.0.5mol·L-1盐酸 C.0.5mol·L-1醋酸 D.0.5mol·L-1NH4Cl溶液
3.在稀氨水中:①加入NH4Cl ②通入NH3 ③煮沸 ④加压 ⑤加入少量NaCl,其中能使碱性增强的是( )
A.①②④ B.②③④ C.②④ D.④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com