
6.理学对先秦儒学的继承和发展主要表现在吸取其 ( )
A.仁政思想 B.伦理思想
C.唯物主义 D.佛道教义
5.你认为右面这部书中,可以查到哪些书的部分内容 ( )

①《诗经》 ②《尚书》 ③《春秋繁露》 ④《春秋》
A.①②③④ B.①②④
C.②③④ D.①②③
4.由央视《百家讲坛》通过讲述《论语--心得》走出并迅速蹿红的北京师范大学于丹教授,一方面她的讲座得到大众热烈欢迎,书也成为极度走俏的畅销书;于丹成为时代超女,从根本上看是得益于 ( )
A.显赫的学术地位 B.口若悬河的口才
C.把历史知识通俗化 D.儒家思想的魅力
3.董仲舒为儒学增加了“君权神授”“天人感应”的内容,以下皇帝的行为不属于这一理论应用的是 ( )
A.皇帝即位要举行祭天仪式 B.为了加强皇权而取消宰相
C.皇帝重视发生的自然灾害 D.“奉天承运”是诏书中的常用语
2.老师发现小明考试作弊,想找他谈心,这时候老师可以引用孔子的主张是 ( )
A.“因材施教” B.“知之为知之,不知为不知”
C.“温故而知新” D.“学而不思则罔,思而不学则殆”
1、孔子教育思想中与其“贵贱有序”的政治主张相矛盾的是 ( )
A.因材施教 B.有教无类
C.学而不思则罔 D.知之为知之
14.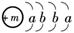 (13分)2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(13分)2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=________,该融雪剂的化学式为________.
(2)Z、W元素的名称为__________、__________.
(3)下列说法正确的是________.
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
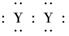 (4)下列化学用语表达正确的是________.
(4)下列化学用语表达正确的是________.
A.XY2的电子式:X2+[ ?]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:
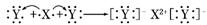 Y2+Z2-===2Y-+Z↓
Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为:
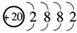
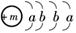 (5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_____________________________________________________________________.
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_____________________________________________________________________.
解析:(1)由X原子的结构示意图 可推知其为 ,该元素为Ca,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知 Y为Cl.
(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S.Z与Y相邻则Z是S,W是C.
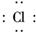
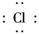 (3)CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,A错误,B正确;S的非金属性弱于Cl,则H2S的稳定性比HCl弱,C错误.Ca2+、Cl-具有相同的电子层结构,但Ca元素的核电荷数大,离子半径小,D错误.
(3)CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,A错误,B正确;S的非金属性弱于Cl,则H2S的稳定性比HCl弱,C错误.Ca2+、Cl-具有相同的电子层结构,但Ca元素的核电荷数大,离子半径小,D错误.
(4)XY2为CaCl2,其电子式为[? ?]-Ca2+[? ?]-,H2S的水溶液为弱酸,应写成分子式,即Cl2+H2S===2H++2Cl-+S↓,A、C错误.
(5)氢键影响物质的熔沸点,使水的沸点升高.
答案:(1)20 CaCl2 (2)硫 碳 (3)B (4)B、D
(5)水分子间存在氢键
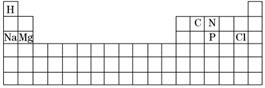
13.(13分)(1)科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部属于周期表前20号元素,其余0.03%是由十多种人体不可缺少的微量元素组成.现有a-g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在周期表中的位置如下,请据此回答下列问题:
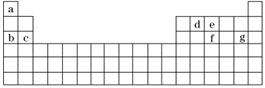
①元素的原子间反应最容易形成离子键的是下列中的________(填序号,下同),元素的原子间反应容易形成共价键的是下列中的________.
A.c和f B.b和g
C.d和g D.b和e
②下列由a-g形成的各分子中所有原子都满足最外层为8电子结构的是________.
A.ea3 B.ag
C.fg3 D.dg4
(2)多数元素的原子不能稳定存在,形成化学键是达到元素原子稳定存在形式的唯一途径.请回答:
①水分子的组成为什么是H2O而不是H3O?你的解释是___________________
_____________________________________________________________________
____________________________________________________________________.
②稀有气体分子中为什么不存在化学键?你的解释是
____________________________________________________________________
______________________________________________________________________
______________________________________________________________________.
解析:(1)①一般情况下,活泼金属元素的原子与活泼非金属元素的原子间易形成离子键,而非金属元素的原子间形成的是共价键.先确定a-g 7种元素(如下表),再根据金属性和非金属性的强弱来判断.7种元素中最活泼的金属b(Na)和非金属g(Cl)之间最容易形成离子键,而非金属元素之间一般易形成共价键.
②选项中对应的分子分别为NH3、HCl、PCl3、CCl4,其中NH3、HCl中由于氢形成的是2电子稳定结构,故不符合题意.而PCl3中,磷原子核外最外层电子数为5,它与氯原子形成共价键时,构成PCl3中的磷原子、氯原子最外层都达到8电子结构.同理,CCl4亦符合题意.
(2)原子通过电子得失或共用电子对的偏移达到稳定结构,从而结合成分子,因此不存在H3O;稀有气体分子中没有化学键.
答案:(1)①B C ②CD
(2)①氧原子最外层有6个电子,要达稳定结构缺2个电子,每个氢原子有1个电子,这样,两个氢原子与1个氧原子形成两对共用电子对,各自都形成稳定结构,所以是H2O,而不是H3O
②因稀有气体原子的最外层都已达稳定结构,不需要得失电子,也不需要形成共用电子对.故不存在化学键,其分子为单原子分子
12.(13分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10电子的化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为______________;化合物BA4的电子式为____________.
(2)化合物Y2X2中含有的化学键类型有________(填序号).
A.离子键 B.极性共价键
C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是________(填化学式),其主要原因是________________________________________________________________________.
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为_____________________________________________________________________
________________________________________________________________________.
解析:(1)Y2X2与水反应生成X单质,其溶液可使酚酞试液变红,Y为Na,X为O.又X与Z同主族,则Z为S,A、B、X、Y、Z原子序数递增,B与Z最外层电子数之比为2∶3,B为C,又A与B和X均可形成10电子化合物,A为H.化合物BA4为CH4.
(2)Y2X2为Na2O2,既含有离子键又含有非极性共价键.
(3)H2S和H2O相比,H2O沸点高,因为水分子间存在氢键.
(4)H2O2具有氧化性,H2S具有强还原性,H2O2与H2S反应生成H2O和S.
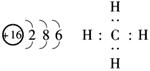
答案:(1)
(2)AC (3)H2O 水分子间存在氢键
(4)H2O2+H2S===2H2O+S↓
11.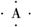 (11分)有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为 , B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24
L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(11分)有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为 , B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24
L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
 (1)写出A、B、C、D元素的名称:
(1)写出A、B、C、D元素的名称:
A________,B________,C________,D________.
(2)D元素在周期表中属第________周期________族.
(3)用电子式表示A的气态氢化物的形成过程:
________________________________________________________________________.
(4)A和B的单质充分反应生成化合物的结构式是______________________________.
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?________________________________________________________________________
________________________________________________________________________.
解析:由A的电子式可知,A为碳或硅,又因为原子序数依次增大且小于18,则A为碳,根据B的原子结构可知B为氧;0.1 mol C可从酸中置换出0.1 mol H2,则C为+2价金属,故为镁;根据D的电子层结构可知D为铝.
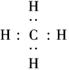 答案:(1)碳 氧 镁 铝 (2)三 ⅢA
答案:(1)碳 氧 镁 铝 (2)三 ⅢA
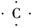 (3) +4H―→
(4)O===C===O
(3) +4H―→
(4)O===C===O
(5)B与C形成的化合物是MgO,为离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com