
1.(2001年春季高考题)将NaCl、KBr和CaCl2的混合物10.000g溶于水中,通入足量的氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为9.813g。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.721g。求原混合物中各化合物质量。
(该题考查学生对诸多单质及化合物性质的掌握情况。答题的关键在于正确书写化学方程式,分析反应前后物质的变化及质量变化原因,找出差量关系进行运算。)
5.无数据计算题较特殊,字里行间无任何数据,却要进行计算。这类题型在一定程度上增大了解题的难度和迷惑性,但只要掌握了它的解法,并不难。无数据型计算题的常用解法有等量法、假设法和推理法等。
数据缺省型题目的特点是:构成计算要素的已知量缺省,要求学生根据计算要求补充这一缺省量,然后进行有关计算。数据缺省型计算题是近几年国家命题组开发出来的成功计算题型。此类试题对考查学生逻辑思维能力及学习潜能特别有效。
典型题点击
4.混合物反应的计算是化学计算中的一种最基本的类型。混合物可以是固体、气体或溶液,解题过程中必须仔细审题,理清各物质之间量的关系,必要时可采用图示或简捷的化学用语表示。二元混合物是混合物计算中最重要也是最基本的一种类型,其一般解题思路是:设两个未知数,然后根据有关反应的化学方程式中物质的量关系,列出二元一次方程组求解。
3.多步反应的计算应先写出有关反应的化学方程式,然后找出起始物质与最终物质之间的关系,再用关系式进行计算。此类题目往往涉及物质纯度、转化率、利用率、产率等概念。
2.判断反应物中有一种过量的化学计算题出现较多,其判断的方法因题型(即所给已知条件)不同而不同。常见的方法有常规方法、极端假设法、产物逆推法等,判断的方法灵活多变,具有一定的难度。解此类题时,应先确定哪种反应物过量,必须以不足量的反应物的量求算生成物的量。
1.正确理解化学方程式“质”和“量”两方面的涵义,准确书写化学方程式,并求出相关物质的摩尔质量,这是化学方程式计算的关键。
(1)计算过程:设未知→列化学方程式(或关系式)→找相关物质,列出关系量→列比例式→解未知→答。
(2)注意点:a.反应式所表示的是纯物质的相关量,不纯物质或溶液应先换算为纯物质的量,才可代入计算。
b.可用反应过程中质量变化量(质量差)或体积变化量(体积差)建立比例关系,进行计算。
11.(1)40
(2)2CaSO4·H2O(或CaSO4·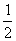 H2O)
H2O)
因为在加热过程中生石膏CaSO4·2H2O转化为相对稳定的2CaSO4·H2O,所以出现了图象中的ab段。
10.(1)0.53
(2)设生成CO2的丁烷有xmol, 生成CO的丁烷有ymol, 则
C4H10+ 6.5O2 = 4CO2+ 5H2O(液)
xmol 6.5xmol 4xmol 5xmol
C4H10 +4.5O2 =4CO + 5H2O(液)
ymol 4.5ymol 4ymol 5ymol
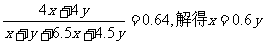
则n(CO2):n(CO):n(H2O)=4x:4y:(5x+5y)=4×0.60y:4y:(5×0.60y+5y)=3:5:10
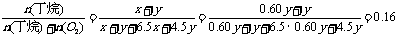
9.(1)一定会发生的反应是:
CuO+H2SO4 CuSO4+H2O
CuSO4+Fe FeSO4+Cu
可能会发生的反应是:H2SO4+Fe FeSO4+H2↑
而n(H2SO4)=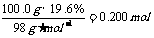
n(Fe)=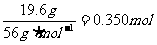
由于n(Fe)>n(H2SO4),所以0.200molH2SO4全部转化为FeSO4,而铁粉只被消耗0.200mol,还有剩余。因此干燥后的固体物质是铁和铜的混合物。
(2)剩余铁粉的质量m(Fe,余)=(0.350mol-0.200mol)×56g·mol=8.40g
铜的质量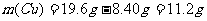
氧化铜的质量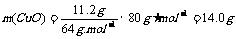
8.(1)
m(S)= 0.2mol/L×0.1L×32g/mol+0.8mol×32g/mol=26.2g
(2)n(Na2SO3)=12.6g÷126g/mol=0.1mol
n(SO2)=0.1mol- 0.2mol/L×0.1L=0.08mol
V(SO2)=0.08mol×22.4L/mol=1.792L 即1792mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com