
12. (09年福建理综·12)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
(09年福建理综·12)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2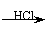
 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |

 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A.增大c(CH3COCH3), v(Br2)增大 B.实验②和③的v(Br2)相等
A.增大c(CH3COCH3), v(Br2)增大 B.实验②和③的v(Br2)相等
 C.增大c(HCl), v(Br2)增大 D.增大c(Br2),v(Br2)增大
C.增大c(HCl), v(Br2)增大 D.增大c(Br2),v(Br2)增大
答案:D
解析:从表中数据看,①④中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
10.(08年山东理综·14)高温下,某反应达到平衡,平衡常数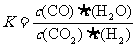 。恒容时,温度升高,H2浓度减小。下列说法正确的是A
。恒容时,温度升高,H2浓度减小。下列说法正确的是A
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
 CO2+H2
CO2+H2
答案:A
解析:由平衡常数的表达式可得,该反应化学方程式应为CO2+H2
 CO+H2O,故D错;由题意知,温度升高,平衡向正反应移动,说明正反应为吸热反应,故该反应的焓变为正值,A正确;恒温恒容下,增大压强,H2浓度一定增大而不会减小,故B错;C项,升高温度,正逆反应速率都会 增大,故C错。
CO+H2O,故D错;由题意知,温度升高,平衡向正反应移动,说明正反应为吸热反应,故该反应的焓变为正值,A正确;恒温恒容下,增大压强,H2浓度一定增大而不会减小,故B错;C项,升高温度,正逆反应速率都会 增大,故C错。
11 .(09年安徽理综·11)汽车尾气净化中的一个反应如下:
.(09年安徽理综·11)汽车尾气净化中的一个反应如下: NO(g)+CO(g)
NO(g)+CO(g) N2(g)+CO2(g) △H=-373.4kJ·mol-1。
N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:

 答案:C
答案:C
 解析:该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;同理,升高温度,平衡逆向移动,CO的转化率减小,B选项错误;平衡常数只与热效应有关,与物质的量无关,C选项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D选项错误。
解析:该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;同理,升高温度,平衡逆向移动,CO的转化率减小,B选项错误;平衡常数只与热效应有关,与物质的量无关,C选项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D选项错误。
9.(08年海南化学·10)X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于D
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于D
A.33% B.40% C.50% D.66%
答案:D
解析:由可知: X+2Y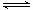 2Z
2Z
起始: 1 1 0
转化: a 2a 2a
平衡: 1-a 1-2a 2a
根据题意有: = ,a=,Y的转化率最接近65%。
8.(08年广东理基·36)对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
答案:A
解析:A. 通入大量O2,反应物浓度增大,正反应速率增大;
B. 增大容积,反应物、生成物浓度均减小,正、逆反应速率均下降;
C. 移去部分SO3会减小生成物浓度,刚开始正反应速率不变,而后下降;
D. 该反应为放热反应,但是降低体系温度正、逆反应速率均减小;同理若增大体
系问题,正、逆反应速率增大;
7.(08年广东化学·15)碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)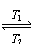
 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是AD
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是AD
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W1W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是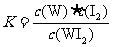
D.利用该反应原理可以提纯钨
答案:AD
解析:该反应的正反应为放热反应,温度升高,化学平衡向左移动。所以灯丝附近温度越高,WI2的转化率越高,B错。平衡常数,应为生成物除以反应物:
K=c(WI2)/c(W)·c(I2)利用该反应,可往钨矿石中,加如I2单质,使其反应生成WI2富集,再通过高温加热WI2生成钨,从而提纯W,D正确。
6.(08年广东化学·8)将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
 2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A
2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A
A.a>b B.a=b C.a<b D.无法确定
答案:A
解析:正反应为放热反应,前者恒温,后者相对前者,温度升高。使平衡向左移动,从而使Br2的转化率降低。所以b<a.
5.(08年宁夏理综·12)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
答案:C
解析:求①的平衡常数的关键是求氨气的平衡浓度,若碘化氢不分解时,NH3(g)和HI(g) 的平衡浓度是相等的,因此2c(H2) 与容器中平衡浓度c(HI)之和即为氨气的平衡浓度5 mol·L-1,故此温度下反应①的平衡常数为20。
4.(07年广东化学·18)下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
答案:BC
解析:本题是一道实验题。A选项中SO2通入酸性KMnO4溶液中,KMnO4做氧化剂,说明SO2具有还原性。B选项中将Cl2通入NaBr溶液中发生Cl2+2NaBr=2NaCl+Br2反应,根据氧化还原反应规律可知Cl2的氧化性大于Br2。C中发生的反应为Cu+4HNO3=Cu(NO3)2+2NO2+2H2O、2NO2(g) N2O4;△H<0,升温气体颜色变深,降温气体颜色变浅,D选项中H2O2溶液的浓度不同,故不能单纯判断催化剂对分解速率的影响。
N2O4;△H<0,升温气体颜色变深,降温气体颜色变浅,D选项中H2O2溶液的浓度不同,故不能单纯判断催化剂对分解速率的影响。
3.(07年广东理基·26)把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
A.盐酸的浓度 B.铝条的表面积
C.溶液的温度 D.加少量Na2SO4
答案:D
解析:铝与盐酸反应的实质是2Al+6H+=2Al3++3H2↑,因此盐酸的溶度、铝条的表面积和溶液的温度均会影响反应的速率,而加少量Na2SO4对溶液中的各物质的浓度没有影响,不会影响反应速率。
2.(07年广东化学·16)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) Sn(s、白)
△H3=+2.1kJ·mol-1
Sn(s、白)
△H3=+2.1kJ·mol-1
下列说法正确的是
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
答案:D
解析:②-①可得③,△H2-△H1>0,故△H2>△H1 ,A错,根据③,在常温下,灰锡会向白锡转化故常温下以白锡状态存在,正反应为吸热反应,故B、C错,当锡制器皿长期处于低于13.2℃的环境中会转化为灰锡,灰锡以粉末状存在,故会自行毁坏。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com