
10.(08年海南化学·6)下列离子方程式正确的是D
A.H2O2+2OH- 2H2O+O2↑
2H2O+O2↑
B.Cl2+6OH- ClO3-+5Cl-+3H2O
ClO3-+5Cl-+3H2O
C.2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
D.3MnO42-+4H+=2MnO4- +MnO2↓+2H2O
答案:B、D
解析:选项A中方程式两边的电荷不守恒;选项C中得失电子数目不等。
9.(08年广东理基·30)下列反应的离子方程式正确的是C
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+H+=Al3++3H2O
D用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+
答案:C
解析:A. 原子不守恒,正确写法为:2Na+2H2O=2Na++2OH-+H2↑
B. HClO是弱酸,不应该拆开,正确写法为:Cl2+H2O=H++Cl-+HClO
C. 胃酸主要成分为HCl,是强酸,该离子方程式正确。
D. 电荷不守恒,正确写法为:2Fe3++Cu=2Fe2++Cu2+
8.(08年广东理基·29)下列各组离子一定能大量共存的是B
A.在含有大量[Al(OH)4]- 溶液中NH4+、Na+、Cl-、H+
B.在强碱溶液中 Na+、K+、CO32-、NO3-
C.在pH=12的溶液中 NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1 mol·L-1的溶液中K+、I-、Cl-、NO3-
答案:B
解析:A. [Al(OH)4]-即为AlO2-,不能在酸性溶液中存在,与NH4+会发生双水解反应;
B. 强碱溶液中,CO32-是可以存在的;
C. NH4+在碱性条件下会与溶液中的OH-结合生成一水合氨分子,不能大量存在;
D. 在酸性溶液中,NO3-具有强氧化性,可将I-氧化(但不能将Cl-氧化)。
7.(08年广东化学·11)下列化学反应的离子方程式正确的是A
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O
答案:A
解析:HClO有强氧化性,可把SO32-氧化为SO42-,B错。稀HNO3有氧化性,可把S2-与Fe2+氧化,应为FeS+4HNO3=Fe(NO3)3+S↓+NO+H20(还有可能生成SO2,SO3) C错。D应为Ca2++ 2OH- +2H+ + SO42- ==CaSO4↓ + 2H2O,所以D错。
6.(2007海南·12)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl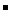 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
答案:D
考点:本题考查了物质的量的相关计算。
解析:本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl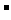 )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[Cl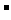 ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl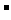 )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
5.(2007海南·11)在pH=1时,可大量共存且形成无色溶液的一组离子或分子是( )
A.Ca2+、CH3COOH、Br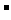 、Na+ B.NO
、Na+ B.NO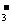 、Fe3+、Mg2+、SO
、Fe3+、Mg2+、SO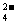
C.HClO、Ba2+、Na+ 、Cl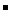 D.K+、Cl
D.K+、Cl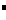 、Al3+、SO
、Al3+、SO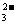
答案:A
考点:本题考查了离子共存问题。
解析:pH=1时,溶液显强酸性,OH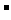 与弱酸根离子都不能共存。所以,D错。B中存在棕黄色的Fe3+,C中HClO与Cl
与弱酸根离子都不能共存。所以,D错。B中存在棕黄色的Fe3+,C中HClO与Cl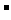 发生氧化还原反应。所以选A。
发生氧化还原反应。所以选A。
4.(2007海南·10)能正确表示下列反应的离子方程式是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO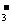 +OH
+OH ==CO
==CO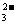 +H2O
+H2O
B.醋酸钠溶液和盐酸混合:CH3COONa+H+ == CH3COOH + Na+
C.少量金属钠放入冷水中:Na+ 2H2O== Na++2OH-+H2↑
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2+ +
SO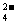 +Ba2+ + 2OH
+Ba2+ + 2OH == Cu(OH)2↓+ BaSO4↓
== Cu(OH)2↓+ BaSO4↓
答案:D
考点:本题考查了离子方程式的正误判断。
解析:离子方程式的正误判断是必考考点,A中产物应有CaCO3沉淀生成;B中CH3COONa为可溶性盐应拆成离子形式;C电荷不守恒。
3.(07年广东理基·36)下列反应的离子方程式正确的是
A.向Ba(OH)2溶液中滴加稀盐酸: 2H++2Cl-+Ba2++2OH- 2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3++Fe 3Fe2+
C.往澄清石灰水中通入过量二氧化碳: Ca2++2OH-+CO2 CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3++Cu Fe2++Cu2+
答案:B
解析:A选项中的BaCl2为易溶于水的强电解质,应写成离子的形式,故错误;C选项中的二氧化碳是过量的应生成可溶性的Ca(HCO3)2,故错误;D选项中的反应电荷不守恒故错误。因此正确的离子方程式为B选项。
2.(07年广东化学·11)下列化学反应的离子方程式正确的是
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
答案:A
解析:离子方程式正误判断主要抓住二个原则,一是符号书写是正确,包括:①原理是否正确②化学式与离子形式拆合是否正确,二是是否守恒。包括:①电荷守恒②电子转移守恒③原子守恒。 题中B选项碳酸镁为难溶物应写化学式,C选项氨水不能使氢氧化铝溶解,D选项应为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O。
1.(07年宁夏理综·11)下列反应的离子方程式正确的是
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
答案:D
解析:A选中的例子方程式电荷不守恒,正确的例子方程式应为Zn+2Ag+=Zn2++2Ag;B选项中的Ca(HCO3)2为可溶性盐,应写为离子符号,正确的离子方程式应为HCO3-+CH3COOH=+CH3COO-+CO2↑+H2O;C选项中的离子方程式质量不守恒,正确的离子方程式应为2Na+2H2O=2Na++2OH-+H2↑;D选项中的离子方程式符合书写要求,是正确的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com