
12. pH=2 的两弱酸HA、HB加水稀释后,溶液 pH随加水量的变化曲线如图所示。则下列叙述正确的是( )
A 电离平衡常数HA > HB
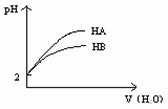 B 等体积的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多
B 等体积的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多
C 等体积的HA和HB 与等质量的Zn反应,HA反应速率大
D 若有等浓度的NaA、NaB,则碱性NaA>NaB
(本题考查的知识点由有:弱电解质的电离及其平衡常数,溶液的pH计算,盐类的水解,综合性较强)
11.0.1mol/L氨水中存在NH3·H2O NH4++OH-的电离平衡,若发生如下的变化时,填入各项的变化情况。
NH4++OH-的电离平衡,若发生如下的变化时,填入各项的变化情况。
|
条件 |
平衡移动方向 |
NH4+的物质的量 |
n(OH-) |
c(NH4+) |
|
加少量盐酸 |
|
|
|
|
|
加少量固体NaOH |
|
|
|
|
|
加水稀释 |
|
|
|
|
|
通入NH3 |
|
|
|
|
|
升高温度 |
|
|
|
|
|
加NH4NO3晶体 |
|
|
|
|
(本题考查的知识是改变外界条件对电离平衡的影响,答题时抓住其本质,综合运用平衡移动原理)
10.从下列现象可以判断某酸是强酸的是( )
A.加热该酸至沸腾也不分解
B.该酸可以分解石灰石放出CO2
C.该酸可以把Al(OH)3沉淀溶解
D.该酸浓度为0.1mol·L-1时的pH为1
(本题考查了对强酸概念的掌握,判断某酸是否为强酸的依据是该酸在水溶液中能否完全电离)
9.下列各组离子在溶液中能大量共存的是( )
A.Ca2+、HCO3-、Cl-、K+ B.Al3+、AlO2-、HCO3-、Na+
C.Fe2+、NH4+、SO42-、S2-? D.Fe3+、SCN-、Na-、CO32
(本题考查了学生对离子共存的问题掌握,主要是要考虑离子间发生复分解而不能大量共存,答题时要逐一排查)
8.在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离平衡向右移动,H+ 浓度减小,可采用的方法是 ( )
A 加热 B 加入0.1mol/L 的醋酸溶液100mL
C 加入少量的0.5mol/L的硫酸
D 加入少量的1mol/L 的NaOH溶液
(此题目的是考查运用电离平衡移动原理解决如何使弱电解质CH3COOH的电离平衡发生如题干所需的改变,答题时要兼顾两个条件。)
7.某酸溶液中[H+]=0.1mol·L-1,则该酸溶液的物质的量浓度 ( )
A.一定等于0.1mol·L-1 B.一定大于0.1mol·L-1
C.一定小于0.1mol·L-1 D.无法确定
(本题考查了酸的电离知识,答题时要注意强酸和弱酸以及多元酸的电离不同)
6.下列物质能导电的是 ( ) ( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴 ⑤蔗糖 ⑥氯化氢气体 ⑦盐酸 ⑧液态氯化氢
A.①④ B.②⑦ C.⑤⑥⑧ D.④⑧
(本题主要考查的知识是电解质导电的条件,电解质不一定导电,导电的物质不一定是电解质,产生自由移动的离子是电解质导电的前提)
5.在同一温度下,弱电解质a,强电解质溶液b,金属导体c的导电能力相同,若升高温度后,它们的导电能力是 ( ) ( )
A.a>b>c B.a=b=c C.c>a>b D.b>c>a
(本题主要考查了溶液以及金属导电能力的影响因素,根据导电的机理加以分析)
4.下列事实能证明甲酸是弱酸的是 ( )
A.在相同温度下,同物质的量浓度的甲酸溶液比盐酸溶液的导电性弱
B.甲酸能与NaHCO3作用放出CO2气体
C.等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和
D.室温下,1 mol/L的甲酸溶液的pH=2
(本题考查的知识点:弱电解质的各种判别方法。能力点:知识再现,分析问题的能力。)
3.0.1mol/L的CH3COOH溶液达到电离平衡时 ( )
A c(CH3COO-)= c(H+)
B c(CH3COOH)= 0.1mol/L
C c(CH3COOH)> c(CH3COO-)
D c(H+)= c(OH-)
(此题主要考查了弱电解质CH3COOH的电离特点,解题时要把握溶液中c(H+)= c(OH-)+c(CH3COO-),可运用排除法)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com