
13.(16分)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol/L H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如图所示.
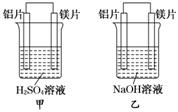
请回答:
(1)写出甲池中正极的电极反应式:_____________________________________.
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极____________________,总反应的离子方程式为
________________________________________________________________________.
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号).
(4)由此实验,可得到如下哪些正确结论?
答:________(填写字母序号).
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”这种做法__________(填“可靠”或“不可靠”).如不可靠,请你提出另一个判断原电池正负极的可行实验方案________________________________________________________________________
________________________________________________________________________
(如可靠,此空可不填).
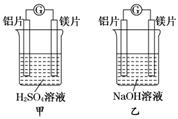
解析:构成原电池的条件中其一是有两种活泼性不同的金属作电极且相对活动的金属作负极.一般比较金属活动性时按照金属活动性顺序.但也有其它情况.因金属活动性顺序的排列是在一般酸中的反应顺序.当溶液改为NaOH溶液时,由于Mg不反应,而Al能跟NaOH溶液反应,在这种情况下,对于NaOH溶液而言,Al比Mg活泼,在该装置中铝作负极.因此,判断原电池正负极时,应考虑到对应介质,谁越易跟电解质溶液反应,谁就作负极.判断原电池正负极,可在两极间连一电流计,根据电流方向来判断,如图所示
答案:(1)2H++2e-===H2↑
(2)Al+4OH--3e-===AlO+2H2O
2Al+2OH-+2H2O===2AlO+3H2↑
(3)Mg Al (4)a、d
(5)不可靠 在两极之间连上一个电流计,测电流的方向,根据“电流由正极流向负极”来判断

12.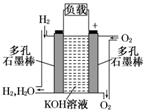 (13分)被誉为改变未来世界的十大新科技之一的燃料电池
(13分)被誉为改变未来世界的十大新科技之一的燃料电池
具有无污染、无噪音、高效率的特点.右图为氢氧燃料电
池的结构示意图,电解质溶液为KOH溶液,电极材料为疏
松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两
极通入燃料电池时,便可在闭合回路中不断地产生电流.
试回答下列问题:
(1)图中通过负载的电子流动方向________(填“向左”或“向右”).
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式.
正极:________________________________________________________,
负极:________________________________________________________________,
总反应:__________________________________________________________.
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在催化剂作用下制取氢气.写出C3H8和H2O反应生成H2和CO的化学方程式:______________________________________________________________________
_______________________________________________________________________;
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,正极反应式为______________________________________________________________________;
负极反应式为____________________________________________________.
解析:H2在负极上被氧化,O2在正极上被还原,电解质溶液为KOH溶液,在书写电极反应式时不出现H+,可以出现OH-.写甲烷燃料电池的电极反应式时,甲烷被O2氧化的产物是CO2,在碱溶液中继续反应生成CO.
答案:(1)向右 (2)2H2O+O2+4e-===4OH-
2H2+4OH--4e-===4H2O 2H2+O2===2H2O
(3)C3H8+3H2O催化剂高温3CO+7H2
(4)2O2+4H2O+8e-===8OH-
CH4+10OH--8e-===CO+7H2O
11.(11分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和
外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
_____________________________________________________________________.
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应______________________________________________________;
负极反应__________________________________________________________.
解析:(1)利用Fe3+转化Fe2+的反应:2FeCl3+Cu===2FeCl2+CuCl2,然后改为离子方程式.
(2)根据2Fe3++Cu===2Fe2++Cu2+氧化还原反应和原电池的工作原理进行设计,铜作负极,石墨作正极,FeCl3溶液作电解质溶液.
答案:(1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如图所示

正极反应:2Fe3++2e-===2Fe2+
负极反应:Cu-2e-===Cu2+
10.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是 ( )
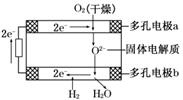
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的负极
C.a极对应的电极反应为O2+2H2O+4e-===4OH-
D.b极对应的电极反应为2H2-4e-+4OH-===4H2O
解析:原电池中失去电子的物质在负极发生反应,故通H2的b极为负极;通O2的a极为正极.据图示a极对应的电极反应为:O2+2e-===O2-,b极对应的电极反应为:H2+O2--2e-===H2O.
答案:B
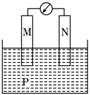
9.下图所示装置中, 观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是 ( )
|
|
M |
N |
P |
|
A |
锌 |
铜 |
稀硫酸溶液 |
|
B |
铜 |
铁 |
稀盐酸 |
|
C |
银 |
锌 |
硝酸银溶液 |
|
D |
锌 |
铁 |
硝酸铁溶液 |
解析:该原电池中M棒变粗,N棒变细,说明原电池反应时N棒溶解作负极,溶液中有金属析出在M棒上.M棒作正极.A、B选项中,电解质溶液分别为稀H2SO4和稀盐酸,原电池工作时,不会有金属析出;C选项正极反应为Ag++e-===Ag,符合题意;而D选项正极反应为Fe3++e-===Fe2+,不会有金属析出.
答案:C
8.碱性电池具有容量大,放电电流大的特点,因而得到广泛应用.
锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O===Zn(OH)2+2MnOOH下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:
2MnO2+2H2O+2e-===2MnOOH+2OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
解析:从电池总反应式Zn+2MnO2+2H2O===Zn(OH)2+2MnOOH可以确定Zn为负极,电子从负极流出经外电路流向正极.当外电路中通过0.2 mol电子,参加反应的锌理论上为0.1 mol,即质量减少6.5 g.
答案:C
7.(2010·济宁模拟)一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2.则下列说法中正确的是 ( )
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO
C.负极发生的电极反应是:CO+CO-2e-===2CO2
D.正极发生氧化反应
解析:据题意知通入CO的一极为电源的负极,CO失去电子转变为CO2,发生氧化反应,故A、B、D错误,C正确.
答案:C
6.一个原电池的总反应方程式为Zn+Cu2+===Zn2++Cu,该原电池可能为( )
|
|
A |
B |
C |
D |
|
正极 |
Cu |
Al |
Zn |
Fe |
|
负极 |
Zn |
Zn |
Cu |
Zn |
|
电解质溶液 |
H2SO4 |
CuSO4 |
ZnCl2 |
CuCl2 |
解析:由总反应式可知,Zn被氧化,失去电子,Zn应为负极;Cu2+被还原,得电子,即电解质溶液应含Cu2+,由此排除选项A、C,而且正极金属应比Zn活动性弱,可排除B选项.
答案:D
5.(2009·福建高考)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池.下列判断不正确的是
( )
2Fe2++I2设计成如下图所示的原电池.下列判断不正确的是
( )
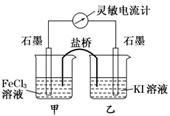
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
解析:由反应2Fe3++2I- 2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,
2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,
乙中I-发生氧化反应;当电流计读数为零时,则反应达到了平衡状态,此时在甲中
溶入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电
极为正极;故选D.
答案:D
4.(2010·南洋月考)利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是 ( )
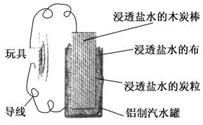
A.铝罐将逐渐被腐蚀
B.炭粒和炭棒上发生的反应为:O2+4e-===2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
解析:该电池的反应原理是:4Al+3O2===2Al2O3,所以Al作电源负极,与玩具的负极相连,逐渐被腐蚀,A正确,C、D错误;B选项中正确的反应式为:O2+2H2O+4e-===4OH-.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com