
2. 在100 mL 0.10 mol/L的 AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.10 mol/L
1.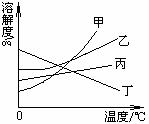 我国西北部有许多盐碱湖,湖水中有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐。据此,你认为图中________的溶解度曲线与纯碱的溶解度曲线最相似。
我国西北部有许多盐碱湖,湖水中有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐。据此,你认为图中________的溶解度曲线与纯碱的溶解度曲线最相似。
A.甲 B.乙
C.丙 D.丁
4.阿伏加德罗常数(NA)、物质的量(n)和粒子数(N)之间有如下关系:NA=N / n。测定阿伏加德罗常数有多种方法,其中电解法是常用的方法。试回答下列有关问题。
(1)现实验室有同样浓度的氯化钠、硫酸铜、硝酸银、硫酸等溶液。若实验过程中不考虑电极上的析出物质与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,实验既简便、测定结果误差又小,并说明理由______________________________________。
(2)采用你所选定的溶液来实验,至少应测定哪些数据?___________________________。
(3)若已知1个电子的电量为q,选定符号代表有关物理量,列出计算阿伏加德罗常数(NA)的数学表达式。
[课后巩固]
3. 根据下图所示,A、B、C、D四种物质的溶解度曲线,完成下列问题:
根据下图所示,A、B、C、D四种物质的溶解度曲线,完成下列问题:
(1)当温度高于0℃低于t1℃时,四种物质溶解度由大到小的顺序是________。
(2)温度在________℃时,B、D两物质溶解度相等。
(3)随温度升高,D物质溶解度________。
(4)要想得到四种物质的晶体,A、B采取________方法,C采取________方法,D采取________方法,分离A、C可用________方法。
2. 将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量
B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡
D.溶液中Ca2+的数目、Ca(OH)2的溶解平衡
1.20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为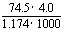 ×100%
×100%
C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
4.有关溶液pH的简单计算
(1)一种强酸或一种强碱的pH计算
强酸:先求c(H+),再求pH:如HnA,浓度为cmol/L,pH=-lgc(H+)=-lgnc。
强碱:先求c(OH-),然后由KW换算成c(H+),再求pH或直接求pOH,再根据关系式pH=14-pOH求。如B(OH)n,浓度为cmol/L,pH=-lgc(H+)=14+lgnc。
(2)关于两强(强酸或强碱)混合pH的计算
①两强酸混合,先算c混(H+),再算pH,c混(H+)=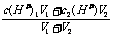
②两强碱混合,先算c混(OH-),再算c混(H+),最后算pH,c混(OH-)=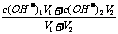
(3)强酸强碱混合,其中一种物质过量的pH的计算
①酸过量时,先求c混(H+),再求pH,c混(H+)=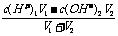
②碱过量,先算c混(OH-),再算c混(H+),最后算pH,c混(OH-)=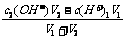
(4)溶液稀释时pH的计算
①对于强酸溶液,c(H+)每稀释10n倍,pH增大n个单位,但不突破7。
②对于强碱溶液,c(OH-)每稀释10n倍,pH减小n个单位,但不突破7。
③对于pH相同的强酸与弱酸(或强碱与弱碱)稀释相同倍数时,pH变化程度不同,其结果是强酸(或强碱)pH变化大,而弱酸(或弱碱)pH变化小。
[典型例析]
例1:20℃时,硫酸的密度和物质的量浓度对照表如下:
|
ρ/g·cm-3 |
1.01 |
1.07 |
1.14 |
1.22 |
1.30 |
1.40 |
1.50 |
1.61 |
1.73 |
1.81 |
1.84 |
|
c/mol·L-1 |
0.10 |
1.10 |
2.33 |
3.73 |
5.30 |
7.14 |
9.18 |
11.50 |
14.12 |
16.62 |
18.40 |
(1)将浓度为c1密度为ρ1和浓度为c2密度为ρ2(c1> c2)两种硫酸溶液混合,所得溶液的密度_______(选填序号)。
A.等于(ρ1+ρ2)/2 B.小于(ρ1+ρ2)/2
C.大于(ρ1+ρ2)/2 D.以上均可能
(2) 将18.4mol/L的浓硫酸100mL加水稀释成5.3mol/L,则稀释后稀硫酸的体积为_________,加入的水的体积为______mL(所有数据均在20℃时测定,20℃时水的密度近似看成1g/cm3)。
(3)现有H2SO4和Na2SO4的混合溶液200mL,其中的H2SO4的物质的量浓度为1 mol/L, Na2SO4的物质的量浓度为0.5 mol/L。若要使 H2SO4和Na2SO4 的物质的量浓度分别为2 mol/L 和0.2 mol/L ,应加入98%的浓硫酸________mL,再加入蒸馏水稀释至_______mL才能实现。
变式训练:
有两份溶液,其中所含溶质相同,设其摩尔质量为M g/mol。根据下表信息,回答有关问题:
|
|
溶质的质量分数 |
溶液的密度(g·cm-3) |
|
第一份溶液 |
ω1 |
ρ1 |
|
第二份溶液 |
ω2 |
ρ2 |
(1)第一份溶液中,溶质的物质的量浓度为__________。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3=______________。
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小?___________________________________________。
例2:下列说法不正确的是
A.25℃时,0.1mol/LHNO3和0.1mol/LCH3COOH的混合溶液的pH约为1
B.25℃时,Mg(OH)2悬浊液中由Mg(OH)2电离出的c(OH-)≈10-4mol/L,则Mg(OH)2悬浊液的pH约为10
C.25℃时,Fe(OH)3悬浊液中由Fe(OH)3电离出的c(OH-)≈10-10mol/L,则Fe(OH)3悬浊液的pH约为4
D.25℃时,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH应为10.5
变式训练:
室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
例3:已知Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)= c(Ag+) 2·c(CrO42-)=1.9×10-12。一个学生通过实验验证醋酸银(CH3COOAg)的Ksp。实验中用了如下的反应:2Ag+(aq)+Cu(s)  2Ag(s)+Cu2+(aq)。这个学生将已知质量的铜片加入到CH3COOAg饱和溶液中,待充分反应之后,将铜片冲洗干净、干燥、重新称量。
2Ag(s)+Cu2+(aq)。这个学生将已知质量的铜片加入到CH3COOAg饱和溶液中,待充分反应之后,将铜片冲洗干净、干燥、重新称量。
(1)写出能表示CH3COOAg的沉淀溶解平衡的方程式:___________________________。
(2)CH3COOAg的Ksp=2.0×10-3。铜片刚开始的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,此饱和溶液中没有CH3COOAg固体。通过计算说明充分反应后铜片中铜的质量为何值时,CH3COOAg的Ksp得到证实。
(3)为什么做此实验时CH3COOAg饱和溶液中必须没有CH3COOAg固体?
。
变式训练:
已知一些银盐的数据如下:
|
化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
|
颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
|
溶解度/g |
1.5×10-4 |
7.1×10-7 |
2.1×10-7 |
1.3×10-16 |
4.3×10-2 |
测定水体中氯化物的含量,常用标准硝酸银法进行滴定。滴定时,应加入的指示剂是
A.KBr B.KI C.K2S D.K2CrO4
[当堂反馈]
3.物质的量浓度、溶解度、质量分数的相互换算
(1)溶质的质量分数w与物质的量浓度c
 (密度的单位为g·cm-3或者g·
mL-1)
(密度的单位为g·cm-3或者g·
mL-1)
(2)饱和溶液的质量分数与溶解度:w=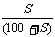 ×100%,c=
×100%,c=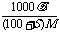
(3)标准状况下求气体溶解于水后所得溶液的物质的量浓度的计算
c=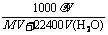 ,式中V为标准状况下气体体积,V(H2O)为水的体积,ρ为溶液的密度(密度的单位为g·cm-3或者g· mL-1)。
,式中V为标准状况下气体体积,V(H2O)为水的体积,ρ为溶液的密度(密度的单位为g·cm-3或者g· mL-1)。
1.有关溶液混合稀释的计算
(1)不同物质的量浓度溶液的混合
稀释,抓住稀释前后溶质的物质的量不变,列方程式:c1·V1=c2·V2
①如果忽略溶液体积变化,则c1·V1+c2·V2=c混·(V1+V2)
②如果考虑溶液混合后的体积改变,则c1·V1+c2·V2=c混·V混(V混=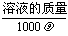 )
)
(2)不同质量分数的两种溶液混合的计算
混合:抓住混合前后溶质的质量不变,列方程式:m1·w1+ m2·w2=(m1+m2)·w混
(3)两种同溶质溶液等质量混合、等体积混合时质量分数的判定
①等质混:两种同溶质液体(或某溶液与水)等质量混合时:w混=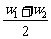 ;
;
②等体混:两种同溶质液体(或某溶液与水)等体积混合时:w混∈[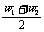 ,w (ρ大)]。
,w (ρ大)]。
31. (26分)
(26分)
 Ⅰ.夏季,将一植株放在密闭玻璃罩内,置于室外一昼夜,获得实验结果如下图所示。请回答下列问题:
Ⅰ.夏季,将一植株放在密闭玻璃罩内,置于室外一昼夜,获得实验结果如下图所示。请回答下列问题:

|
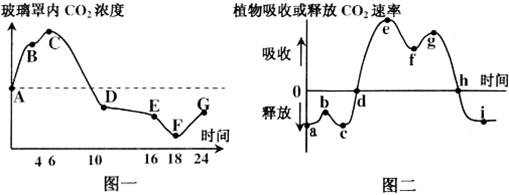
 (1)图二中的b点对应于图一中的________点,导致图二曲线在b点上升可能的原因是___________。
(1)图二中的b点对应于图一中的________点,导致图二曲线在b点上升可能的原因是___________。
 (2)图二中的ef段的C3的含量_____(填“增多”或“减少”),gh段C5的含量____(填“增多”或“减少”)。
(2)图二中的ef段的C3的含量_____(填“增多”或“减少”),gh段C5的含量____(填“增多”或“减少”)。
 (3)到达图二中__________点时,植物体积累的有机物最多。i点时植物形成ATP的途径有____________。
(3)到达图二中__________点时,植物体积累的有机物最多。i点时植物形成ATP的途径有____________。
 (4)经过这一昼夜之后,植物体的有机物含量会___________。(填“增加”、“减少”或“不变”)
(4)经过这一昼夜之后,植物体的有机物含量会___________。(填“增加”、“减少”或“不变”)

 Ⅱ. 为探究血糖调节的影响因素,设计如下实验流程。
Ⅱ. 为探究血糖调节的影响因素,设计如下实验流程。



























 据图回答:
据图回答:
 (1)实验中取
的家兔5只,编号①至⑤。其中①号家兔的作用是
。
(1)实验中取
的家兔5只,编号①至⑤。其中①号家兔的作用是
。
 (2)二次注射后,与⑤号家兔相比,若④号家兔产生尿素的量增加,原因是 (物质)大量分解导致的。
(2)二次注射后,与⑤号家兔相比,若④号家兔产生尿素的量增加,原因是 (物质)大量分解导致的。
 (3)二次注射后,低血糖症状最先得到缓解的是 号家兔:若②号家兔出现糖尿,则该兔的尿量将会 (填“增多”或“减少”),鉴定糖尿的试剂是
。
(3)二次注射后,低血糖症状最先得到缓解的是 号家兔:若②号家兔出现糖尿,则该兔的尿量将会 (填“增多”或“减少”),鉴定糖尿的试剂是
。








 命题人:苏公祥 邹永平 彭颂春
命题人:苏公祥 邹永平 彭颂春
 审题人:吴高文 雷 平 陈 渝
审题人:吴高文 雷 平 陈 渝













 重庆一中高2010级高三上期第一次月考
重庆一中高2010级高三上期第一次月考
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com