
15、请根据下列实验数据确定某水合含Fe(II)的盐的化学式。①将0.784g该含亚铁的盐强烈加热至质量恒定,得到0.160gFe2O3;②将0.784g该盐溶于水,加入过量的BaCl2溶液,得到0.932gBaSO4;③0.392该盐溶于水,加入过量的NaOH溶液后煮沸,释放出的氨气用50.0mL 0.10 mol/L盐酸吸收后,吸收液需要30.0mL 0.10mol/LNaOH溶液恰好中和。
14、2 L容器中,分别将物质的量均为2.00 mol的SO2、O2混合,在不同温度(T) 下发生如下反应:2SO2(g)+O2(g) 2SO3(g)。并在第10 s时分别测定其中SO3的体积分数(SO3%)并绘成如图所示曲线:
下发生如下反应:2SO2(g)+O2(g) 2SO3(g)。并在第10 s时分别测定其中SO3的体积分数(SO3%)并绘成如图所示曲线:
(1)此反应的正反应为 热反应;
(2)A、B两点正反应速率的大小关系是:vA vB(填=、>或<,);以O2表示T0对应的平均反应速率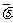 (O2)=
;
(O2)=
;
(3)温度T<T0时,SO3%逐渐增大的原因是
;
(4)若B点SO3的体积分数为40.0%,则SO2的转化率为 (保留3位有效数字);
(5)若将B点的混合气体的5%通入过量的BaCl2溶液,生成沉淀 g。(保留3位有效数字)
13、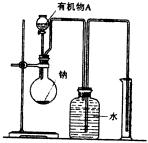 12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2。测得有机化合物A的蒸气与H2的相对密度是30,求:
12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2。测得有机化合物A的蒸气与H2的相对密度是30,求:
(1)有机物A的分子式 。 (2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为bmL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)
12、硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH4)2SO4·FeSO4·6H2O],相对分子质量为392,是常用的分析试剂。在实验室,将FeSO4和(NH4)2SO4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体。某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品。请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡。
。
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+。离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O。滴定时必须选用的仪器有 (从下图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂? 。若需要,请指出加什么指示剂;若不需要,请说明理由。 。
(3)取莫尔盐产品23.520g,配成250mL溶液,取出25.00mL用0.0500mol/LKMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数 。
11、废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末
(1)废旧印刷电路板中回收的铁是新型电池的使用材料,如制成LiFePO4电池,它可用于电动汽车。电池反应为:FePO4+Li  LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
(2)用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
则在H2SO4 溶液中Cu 与H2O2 反应生成Cu2+和H2O的热化学方程式为: 。
(3)部分金属的回收需要氧化性很强的溶液,如金常用 和 的混合溶液溶解
(4)为了分离金属粉末常用到氰酸(HCN)溶液,HCN是一种有毒且较弱的酸,已知:常温下HCN的电离程度非常小,其Ka=6.2×10-10,0.1mol/L的NaCN的pH=11.1,0.1mol/L的NH4CN的pH=9.2, 则浓度都是0.1mol/L的NaCN和NH4CN溶液中,CN-水解程度大小为:NaCN NH4CN(填:> = < ),理由是:
10、( )将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是
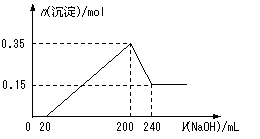 A.Mg和Al的总质量为8 g
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
9、( )用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
8、( )在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH–)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示。
|
序号 |
Ba(OH)2溶液的体积 / mL |
盐酸的体积 / mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
5、( )在一定条件下,下列粒子的还原性顺序为:Cl–<Br–<Fe2+<I–<SO2,由此判断以下各反应在溶液中不能发生的是
A.2Fe3+
+ SO2 + 2H2O  2Fe2+ + SO42–
+ 4H+
2Fe2+ + SO42–
+ 4H+
B.I2
+ SO2 + 2H2O  4H+ + SO42–
+ 2I–
4H+ + SO42–
+ 2I–
C.2Fe2+
+ Cl2  2Fe3+ + 2Cl–
2Fe3+ + 2Cl–
D.2Br–
+ 4H+ + SO42– SO2 + Br2
+ 2H2O
SO2 + Br2
+ 2H2O
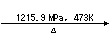 ( )6、白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:白磷
黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是
( )6、白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:白磷
黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是
A.黑磷与白磷互为同分异构体 B.黑磷能导电
C.白磷转化为黑磷是氧化还原反应 D.白磷转化为黑磷是吸热反应
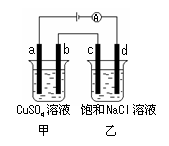 ( )7、如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
( )7、如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
A.乙烧杯中d的电极反应为 2Cl––2e– Cl2↑
Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
|
 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑3、( )下列各组物质中,能发生不同化学反应的是
①C与O2 ②P与Cl2 ③Fe与Cl2 ④Na与O2
⑤CO2与NaOH溶液 ⑥Cu与硝酸 ⑦ AgNO3溶液与氨水
⑧AlCl3溶液与氨水
A.除③外 B.除③⑧外 C.除③⑦外 D.除⑥⑦⑧外
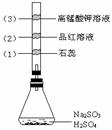 ( )4、如图所示,锥形瓶中加入亚硫酸钠和1:1的硫酸,玻璃管内装入分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是
( )4、如图所示,锥形瓶中加入亚硫酸钠和1:1的硫酸,玻璃管内装入分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
序号 |
(1) |
(2) |
(3) |
|
A |
褪色 |
褪色 |
变红 |
|
B |
变红 |
变红 |
褪色 |
|
C |
变红 |
褪色 |
褪色 |
|
D |
褪色 |
变红 |
褪色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com